編集日時:2021年05月16日(日) 20:55:08履歴

病気よりも悪い?著者
COVID-19 に対する mRNA ワクチンがもたらす予期せぬ結果を検証する
原文 International Journal of Vaccine Theory, Practice, and Research
Stephanie Seneff
Computer Science and Artificial Intelligence Laboratory, MIT, Cambridge MA, 02139, USA
Greg Nigh
Naturopathic Oncology, Immersion Health, Portland, OR 97214, USA
ワープスピード作戦により、米国ではファイザー社とモデナ社が製造した2種類の mRNA ワクチンが発売された。
この2つのワクチンは、中間データでは高い有効性が示唆されており、FDA による緊急使用許可(EUA)の正当性が認められた。
しかし,これらのワクチンが対照試験を経て大量に配備されるまでに異例の速さで進んでいることから,安全性に関する複数の懸念が生じている。
本レビューでは,まず,これらのワクチンの基盤となる技術について詳細に説明する。
次に、これらのワクチンの構成要素と、スパイクタンパク質自体の生成を含むこれらのワクチンに対する意図的な生物学的反応、そして、血液疾患、神経変性疾患、自己免疫疾患など、急性および長期的に引き起こされる広範な病態との潜在的な関係について説明する。
その中でも、スパイクタンパクに含まれるプリオンタンパク関連のアミノ酸配列との関連性について議論する。
また、スパイクタンパクの「シェディング」(ワクチンを接種した人から、ワクチンを接種していない人にタンパクが伝播し、後者に症状が引き起こされること)の可能性を裏付ける研究についても簡単に紹介する。
この現象を明確に証明した研究はないが、これまでに確立された遺伝物質の変換と輸送の経路に基づいて、注射された mRNA が最終的に生殖細胞の DNA に組み込まれて世代を超えて伝達されるという、もっともらしいシナリオを提示している。
最後に、これらの実験的な医薬品の長期的な影響を明らかにし、これらの新しい技術の真のリスク / ベネフィット比をよりよく評価できるようにするために、サーベイランスに関する提言を行う。
この2つのワクチンは、中間データでは高い有効性が示唆されており、FDA による緊急使用許可(EUA)の正当性が認められた。
しかし,これらのワクチンが対照試験を経て大量に配備されるまでに異例の速さで進んでいることから,安全性に関する複数の懸念が生じている。
本レビューでは,まず,これらのワクチンの基盤となる技術について詳細に説明する。
次に、これらのワクチンの構成要素と、スパイクタンパク質自体の生成を含むこれらのワクチンに対する意図的な生物学的反応、そして、血液疾患、神経変性疾患、自己免疫疾患など、急性および長期的に引き起こされる広範な病態との潜在的な関係について説明する。
その中でも、スパイクタンパクに含まれるプリオンタンパク関連のアミノ酸配列との関連性について議論する。
また、スパイクタンパクの「シェディング」(ワクチンを接種した人から、ワクチンを接種していない人にタンパクが伝播し、後者に症状が引き起こされること)の可能性を裏付ける研究についても簡単に紹介する。
この現象を明確に証明した研究はないが、これまでに確立された遺伝物質の変換と輸送の経路に基づいて、注射された mRNA が最終的に生殖細胞の DNA に組み込まれて世代を超えて伝達されるという、もっともらしいシナリオを提示している。
最後に、これらの実験的な医薬品の長期的な影響を明らかにし、これらの新しい技術の真のリスク / ベネフィット比をよりよく評価できるようにするために、サーベイランスに関する提言を行う。
前例のないこと。
この言葉は、2020 年と SARS-CoV-2に 関連するパンデミックについて多くのことを定義している。
前例のない病気とその世界的な対応に加えて、COVID-19 は、ワクチンの研究、製造、試験、一般への配布という前例のないプロセスを開始した(Shaw, 2021)。
COVID-19 に対するワクチンを可能な限り早く市場に投入するために、ドナルド・トランプ大統領(当時)が 2020 年 3 月に「Operation Warp Speed(OWS)」というプログラムを立ち上げた(Jacobs and Armstrong, 2020)。
OWS は、COVID-19 の前例のない側面をさらにいくつか確立した。
まず、アメリカ国防総省がワクチンの配布に関して、アメリカの保健省と直接協力することになった(Bonsell, 2021)。
次に、米国国立衛生研究所(NIH)がバイオテクノロジー企業の Moderna 社と協力して、メッセンジャー RNA(mRNA)をベースにした技術を利用した前例のないタイプの感染症ワクチンを市場に投入した(National Institutes of Health, 2020)。
これらの前例のない出来事が重なったことで、感染症に対する新しい武器としての mRNA ワクチンの将来性と可能性が急速に世間に知られるようになった。
同時に、前例のない出来事は、定義上、リスク、期待される効果、安全性、公衆衛生への積極的な貢献としての長期的な実行可能性を十分に評価するための歴史や文脈を持たない。
本稿では、これらの未曾有の出来事のうち、「SARS-CoV-2」と呼ばれる感染症に対する mRNA ワクチンの開発と展開について簡単に紹介する。
ここで提起する問題の多くは、将来、他の感染症に対する mRNA ワクチンや、がんや遺伝性疾患に関連するアプリケーションにも適用できると考えられるが、現在実施されているコロナウイルスのサブクラスに対する mRNA ワクチンに特に関連するものもある。
この技術の可能性は広く喧伝されてるが、客観的に評価されたリスクや安全性の懸念については、あまり詳しく注目されていない。
ここでは、感染症関連の mRNA 技術の分子的な側面についていくつか検討し、これらを記録された、あるいは潜在的な病理学的影響と関連付けることを意図している。
この言葉は、2020 年と SARS-CoV-2に 関連するパンデミックについて多くのことを定義している。
前例のない病気とその世界的な対応に加えて、COVID-19 は、ワクチンの研究、製造、試験、一般への配布という前例のないプロセスを開始した(Shaw, 2021)。
COVID-19 に対するワクチンを可能な限り早く市場に投入するために、ドナルド・トランプ大統領(当時)が 2020 年 3 月に「Operation Warp Speed(OWS)」というプログラムを立ち上げた(Jacobs and Armstrong, 2020)。
OWS は、COVID-19 の前例のない側面をさらにいくつか確立した。
まず、アメリカ国防総省がワクチンの配布に関して、アメリカの保健省と直接協力することになった(Bonsell, 2021)。
次に、米国国立衛生研究所(NIH)がバイオテクノロジー企業の Moderna 社と協力して、メッセンジャー RNA(mRNA)をベースにした技術を利用した前例のないタイプの感染症ワクチンを市場に投入した(National Institutes of Health, 2020)。
これらの前例のない出来事が重なったことで、感染症に対する新しい武器としての mRNA ワクチンの将来性と可能性が急速に世間に知られるようになった。
同時に、前例のない出来事は、定義上、リスク、期待される効果、安全性、公衆衛生への積極的な貢献としての長期的な実行可能性を十分に評価するための歴史や文脈を持たない。
本稿では、これらの未曾有の出来事のうち、「SARS-CoV-2」と呼ばれる感染症に対する mRNA ワクチンの開発と展開について簡単に紹介する。
ここで提起する問題の多くは、将来、他の感染症に対する mRNA ワクチンや、がんや遺伝性疾患に関連するアプリケーションにも適用できると考えられるが、現在実施されているコロナウイルスのサブクラスに対する mRNA ワクチンに特に関連するものもある。
この技術の可能性は広く喧伝されてるが、客観的に評価されたリスクや安全性の懸念については、あまり詳しく注目されていない。
ここでは、感染症関連の mRNA 技術の分子的な側面についていくつか検討し、これらを記録された、あるいは潜在的な病理学的影響と関連付けることを意図している。
前例のないこと
COVID-19 とその後のワクチン開発の多くの側面は、一般の人々に使用されるワクチンとしては前例のないものである。
その中には次のようなものがある。
1. 注射に PEG(ポリエチレングリコール)を使用したのは初めて(本文参照)
2. 感染性物質に対する mRNA ワクチン技術を使用したのは初めて
3. Moderna 社が製品を市場に投入したのは初めて
4. 公衆衛生当局が接種を受ける人に副反応を予想するように伝えたのは初めて
5. 予備的な有効性データしかない状態で公に実施されたのは初めて(本文参照)
6. 感染、伝達、死亡の減少について明確な主張をしていないワクチンは初めて
7. ヒトで試みられたコロナウイルスワクチンは初めて
8. 遺伝子組換えポリヌクレオチドを一般の人々に注射したのは初めて
感染症に対する mRNA ワクチンの開発は、様々な意味で前例がない。
ビル・アンド・メリンダ・ゲイツ財団が主催した 2018 年の出版物では、ワクチンは3つのカテゴリーに分けられていた。
Simple(単純)、Complex(複雑)、Unprecedented(前例のない)である(Young ら, 2018)。
Simple と Complex のワクチンは、既存のワクチン技術の標準的なアプリケーションと修正されたアプリケーションを表していた。
Unprecedented は、これまで適切なワクチンが存在しなかった疾患に対するワクチンのカテゴリーを表している。
HIV やマラリアに対するワクチンがその例である。
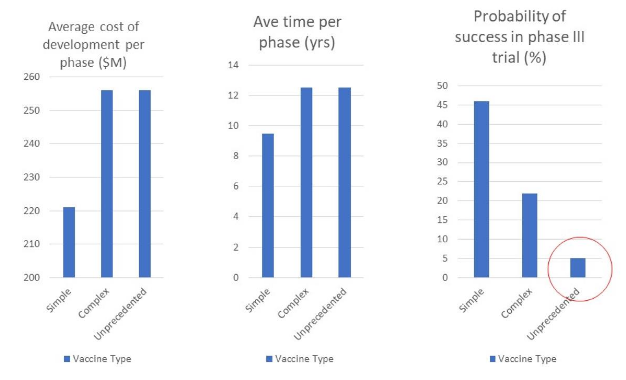
図1に示すように、前例のないワクチンは、開発に 12.5 年かかると予想されている。
さらに不吉なことに、第2相試験(有効性の評価)に成功する確率は 5 %、そのうち第3相試験(集団の有益性の評価)に成功する確率は 40 %と推定されている。
つまり、前例のないワクチンが、第3相臨床試験の段階で成功する確率は 2 %と予測されたのである。
著者が単刀直入に言うと、「特に前例のないワクチンの成功確率は低い 」ということになる。(Young ら, 2018)
それを踏まえた上で、2年後には 90 ~ 95 %の有効性が報告された前例のないワクチンが登場している(Baden ら, 2020)。
実際、こうした有効性の報告は、ワクチン接種導入を国民が支持する最大の動機となっている(米国保健社会福祉省, 2020)。
これは予測だけでなく、期待にも反している。
COVID-19 ワクチンの有効性に対する懸念を訴える声を掲載している従来の著名な医学誌は、BMJ(British Medical Journal)だけかもしれない。
確かに、有効性の推定値は再評価される必要があると考えられる理由がある。
BMJ の副編集長である Peter Doshi は、ワクチンメーカーが FDA に公開した生データのうち、高い有効性を主張する根拠となったデータについて、2つの重要な分析結果を発表した(Doshi, 2021a, 2021b)。
残念ながら、これらは BMJ のブログに掲載されたもので、査読付きの内容ではない。
しかし、Doshi 氏は、BMJ の査読付きコンテンツで、ワクチンの有効性とワクチン試験のエンドポイントの有用性の疑問に関する研究を発表している(Doshi, 2020)。
Doshi 氏の予備的有効性データの批判の中心的な側面は、FDA に提出されたファイザー社のワクチンデータの中間分析に含まれていなかった 3400 件以上の「COVID-19 の疑いのある症例」が除外されていることである。
さらに、モデルナ社とファイザー社の両試験では、過去に感染していたにもかかわらず、ベースラインで SARS-CoV-1 陽性と判断された人が、わずかながらも存在している。
これらの理由やその他の理由から、両ワクチンの中間的な有効性の推定値は 95 %前後であることが疑われる。
高く見積もられたリスク低減効果は相対的なリスクに基づいているが、絶対的なリスク低減効果は、一般の人々がワクチン接種によって個人的に意味のあるリスク低減効果が得られるかどうかを判断する際に、より適切な指標となる。
ワクチンメーカーから FDA に提供されたデータを利用したこの分析では、中間分析の時点で Moderna ワクチンは 1.1 %(p = 0.004)の絶対的リスク低減効果を示し、一方、Pfizer ワクチンの絶対的リスク低減効果は 0.7 %(p < 0.000)であった(Brown, 2021)。
また、COVID-19ワクチンの開発に関して、ここで検討したmRNAワクチンに直接関連する重要な追加の質問を提起した人もいる。
例えば、(Haidere, 2021)は、これらのワクチンの開発に関連する4つの「重要な質問」を特定しており、これはワクチンの安全性と有効性の両方に関連する質問である。
「ワクチンは免疫反応を刺激するのか」
「ワクチンは持続的な免疫力を提供するのか」
「SARS-CoV-2 はどのように変異するのか」
「ワクチンの逆効果に備えているのか」
実装された2つの mRNA ワクチンの標準的かつ長期的な前臨床試験および臨床試験が行われていないため、これらの疑問に対する答えは時間をかけて得られるものである。
これらの疑問を解決するには、一般の人々にワクチンが広く行き渡ることによって得られる適切な生理学的および疫学的データを観察することが必要である。
そしてこれは、公平な結果報告への自由なアクセスがあって初めて可能となるものだが、何としても成功を宣言しなければならないと考えられているために、ワクチン関連情報の検閲が広く行われていることを考えると、その可能性は低いと思われる。
第3相臨床試験を経て、現在、一般の人々に提供されている2つの mRNA ワクチンは、Moderna のワクチンと Pfizer-BioNTech のワクチンである。
これらのワクチンには多くの共通点がある。
どちらも、SARS-CoV-2 ウイルスのスパイクタンパクをコードする mRNA をベースにしている。
どちらも相対的な有効性は 94 ~ 95 %であった。
予備的には、3か月後にも抗体が存在することが示されている。
どちらも3〜4週間の間隔をあけて2回投与することが推奨されており、最近では年1回のブースター注射が必要との報告もある(Mahose, 2021)。
どちらも筋肉注射で投与され、RNA が分解しないように深冷凍保存が必要である。
これは、非常に安定している二本鎖の DNA とは異なり、一本鎖の RNA 製品は、暖かい温度では損傷したり、無力化したりする傾向があり、潜在的な有効性を維持するためには極低温で保存しなければならないからである(Pushparajah et al.、2021)。
ファイザー社のワクチンは、華氏 -94 度(摂氏 -70 度)での保存が必要であるとメーカーは主張しており、最終的に投与されるまでの間の輸送や保冷が非常に困難である。
Moderna ワクチンは、華氏 -4 度(-20 度)で6か月間保存することができ、解凍後 30 日間は冷蔵庫で安全に保存することができる(Zimmer ら, 2021)。
他にも、Johnson & Johnson のワクチンと AstraZeneca のワクチンが、緊急時に投与されている。
どちらも mRNA ワクチンの技術とは全く異なるベクター DNA 技術に基づいている。
これらのワクチンも十分な評価を経ずに市場に投入されたが、本稿のテーマではないので、開発の経緯を簡単に説明する。
これらのワクチンは、風邪の原因となる二本鎖の DNA ウイルスであるアデノウイルスの欠陥品をベースにしている。
このアデノウイルスは、重要な遺伝子が欠損しているために複製できないように遺伝子を改変し、さらに SARS-CoV-2 のスパイクタンパク質の DNA コードをゲノムに追加したものである。
AstraZeneca の製造では、ヒト胚性腎臓(HEK)293 という不死化したヒト細胞株を、欠陥のあるウイルスとともに培養している(Dicksら, 2012)。
HEK 細胞株は、1970 年代に、欠陥ウイルスの複製に必要な欠落した遺伝子を供給するアデノウイルスのセグメントで DNA を補強することにより、遺伝子組み換えが行われた(Louis ら, 1997)。
Johnson & Johnson では、胎児の網膜細胞を用いた同様の手法を採用している。
これらのワクチンの製造には、遺伝子組み換えのヒト腫瘍細胞株が必要であるため、ヒトの DNA が混入する可能性や、その他多くの汚染物質が混入する可能性がある。
メディアはこの革命的な技術に大きな興奮をもたらしているが、スパイクタンパクに対する抗体を作らせるために体を騙すという単純な目的をはるかに超えた、外来の mRNA やこれらのワクチンに含まれる他の成分に対する体の反応の複雑さを認識していないのではないかという懸念もある。
本稿では、まず、mRNA ワクチンの技術について詳しく説明する。
そして、予測可能な悪影響と予測不可能な悪影響の両方の可能性に関して、私たちが懸念する mRNA ワクチンの特定の側面について、いくつかのセクションを割く。
最後に、SARS-CoV-2 に対してできるだけ多くの人々にワクチンを接種するという現在の取り組みに、政府や製薬業界はより慎重になるべきだと訴える。
ビル・アンド・メリンダ・ゲイツ財団が主催した 2018 年の出版物では、ワクチンは3つのカテゴリーに分けられていた。
Simple(単純)、Complex(複雑)、Unprecedented(前例のない)である(Young ら, 2018)。
Simple と Complex のワクチンは、既存のワクチン技術の標準的なアプリケーションと修正されたアプリケーションを表していた。
Unprecedented は、これまで適切なワクチンが存在しなかった疾患に対するワクチンのカテゴリーを表している。
HIV やマラリアに対するワクチンがその例である。
図1に示すように、前例のないワクチンは、開発に 12.5 年かかると予想されている。
さらに不吉なことに、第2相試験(有効性の評価)に成功する確率は 5 %、そのうち第3相試験(集団の有益性の評価)に成功する確率は 40 %と推定されている。
つまり、前例のないワクチンが、第3相臨床試験の段階で成功する確率は 2 %と予測されたのである。
著者が単刀直入に言うと、「特に前例のないワクチンの成功確率は低い 」ということになる。(Young ら, 2018)
【図1】
革新的なワクチンを発売するには、コストと時間がかかる - 特に前例のないワクチンは成功する確率が低い(Young ら, 2018 より引用)
それを踏まえた上で、2年後には 90 ~ 95 %の有効性が報告された前例のないワクチンが登場している(Baden ら, 2020)。
実際、こうした有効性の報告は、ワクチン接種導入を国民が支持する最大の動機となっている(米国保健社会福祉省, 2020)。
これは予測だけでなく、期待にも反している。
COVID-19 ワクチンの有効性に対する懸念を訴える声を掲載している従来の著名な医学誌は、BMJ(British Medical Journal)だけかもしれない。
確かに、有効性の推定値は再評価される必要があると考えられる理由がある。
BMJ の副編集長である Peter Doshi は、ワクチンメーカーが FDA に公開した生データのうち、高い有効性を主張する根拠となったデータについて、2つの重要な分析結果を発表した(Doshi, 2021a, 2021b)。
残念ながら、これらは BMJ のブログに掲載されたもので、査読付きの内容ではない。
しかし、Doshi 氏は、BMJ の査読付きコンテンツで、ワクチンの有効性とワクチン試験のエンドポイントの有用性の疑問に関する研究を発表している(Doshi, 2020)。
Doshi 氏の予備的有効性データの批判の中心的な側面は、FDA に提出されたファイザー社のワクチンデータの中間分析に含まれていなかった 3400 件以上の「COVID-19 の疑いのある症例」が除外されていることである。
さらに、モデルナ社とファイザー社の両試験では、過去に感染していたにもかかわらず、ベースラインで SARS-CoV-1 陽性と判断された人が、わずかながらも存在している。
これらの理由やその他の理由から、両ワクチンの中間的な有効性の推定値は 95 %前後であることが疑われる。
高く見積もられたリスク低減効果は相対的なリスクに基づいているが、絶対的なリスク低減効果は、一般の人々がワクチン接種によって個人的に意味のあるリスク低減効果が得られるかどうかを判断する際に、より適切な指標となる。
ワクチンメーカーから FDA に提供されたデータを利用したこの分析では、中間分析の時点で Moderna ワクチンは 1.1 %(p = 0.004)の絶対的リスク低減効果を示し、一方、Pfizer ワクチンの絶対的リスク低減効果は 0.7 %(p < 0.000)であった(Brown, 2021)。
また、COVID-19ワクチンの開発に関して、ここで検討したmRNAワクチンに直接関連する重要な追加の質問を提起した人もいる。
例えば、(Haidere, 2021)は、これらのワクチンの開発に関連する4つの「重要な質問」を特定しており、これはワクチンの安全性と有効性の両方に関連する質問である。
「ワクチンは免疫反応を刺激するのか」
「ワクチンは持続的な免疫力を提供するのか」
「SARS-CoV-2 はどのように変異するのか」
「ワクチンの逆効果に備えているのか」
実装された2つの mRNA ワクチンの標準的かつ長期的な前臨床試験および臨床試験が行われていないため、これらの疑問に対する答えは時間をかけて得られるものである。
これらの疑問を解決するには、一般の人々にワクチンが広く行き渡ることによって得られる適切な生理学的および疫学的データを観察することが必要である。
そしてこれは、公平な結果報告への自由なアクセスがあって初めて可能となるものだが、何としても成功を宣言しなければならないと考えられているために、ワクチン関連情報の検閲が広く行われていることを考えると、その可能性は低いと思われる。
第3相臨床試験を経て、現在、一般の人々に提供されている2つの mRNA ワクチンは、Moderna のワクチンと Pfizer-BioNTech のワクチンである。
これらのワクチンには多くの共通点がある。
どちらも、SARS-CoV-2 ウイルスのスパイクタンパクをコードする mRNA をベースにしている。
どちらも相対的な有効性は 94 ~ 95 %であった。
予備的には、3か月後にも抗体が存在することが示されている。
どちらも3〜4週間の間隔をあけて2回投与することが推奨されており、最近では年1回のブースター注射が必要との報告もある(Mahose, 2021)。
どちらも筋肉注射で投与され、RNA が分解しないように深冷凍保存が必要である。
これは、非常に安定している二本鎖の DNA とは異なり、一本鎖の RNA 製品は、暖かい温度では損傷したり、無力化したりする傾向があり、潜在的な有効性を維持するためには極低温で保存しなければならないからである(Pushparajah et al.、2021)。
ファイザー社のワクチンは、華氏 -94 度(摂氏 -70 度)での保存が必要であるとメーカーは主張しており、最終的に投与されるまでの間の輸送や保冷が非常に困難である。
Moderna ワクチンは、華氏 -4 度(-20 度)で6か月間保存することができ、解凍後 30 日間は冷蔵庫で安全に保存することができる(Zimmer ら, 2021)。
他にも、Johnson & Johnson のワクチンと AstraZeneca のワクチンが、緊急時に投与されている。
どちらも mRNA ワクチンの技術とは全く異なるベクター DNA 技術に基づいている。
これらのワクチンも十分な評価を経ずに市場に投入されたが、本稿のテーマではないので、開発の経緯を簡単に説明する。
これらのワクチンは、風邪の原因となる二本鎖の DNA ウイルスであるアデノウイルスの欠陥品をベースにしている。
このアデノウイルスは、重要な遺伝子が欠損しているために複製できないように遺伝子を改変し、さらに SARS-CoV-2 のスパイクタンパク質の DNA コードをゲノムに追加したものである。
AstraZeneca の製造では、ヒト胚性腎臓(HEK)293 という不死化したヒト細胞株を、欠陥のあるウイルスとともに培養している(Dicksら, 2012)。
HEK 細胞株は、1970 年代に、欠陥ウイルスの複製に必要な欠落した遺伝子を供給するアデノウイルスのセグメントで DNA を補強することにより、遺伝子組み換えが行われた(Louis ら, 1997)。
Johnson & Johnson では、胎児の網膜細胞を用いた同様の手法を採用している。
これらのワクチンの製造には、遺伝子組み換えのヒト腫瘍細胞株が必要であるため、ヒトの DNA が混入する可能性や、その他多くの汚染物質が混入する可能性がある。
メディアはこの革命的な技術に大きな興奮をもたらしているが、スパイクタンパクに対する抗体を作らせるために体を騙すという単純な目的をはるかに超えた、外来の mRNA やこれらのワクチンに含まれる他の成分に対する体の反応の複雑さを認識していないのではないかという懸念もある。
本稿では、まず、mRNA ワクチンの技術について詳しく説明する。
そして、予測可能な悪影響と予測不可能な悪影響の両方の可能性に関して、私たちが懸念する mRNA ワクチンの特定の側面について、いくつかのセクションを割く。
最後に、SARS-CoV-2 に対してできるだけ多くの人々にワクチンを接種するという現在の取り組みに、政府や製薬業界はより慎重になるべきだと訴える。
ヌクレオチドを用いた遺伝子治療の初期段階では、mRNA 技術よりも DNA プラスミドを用いた遺伝子導入に力が注がれていた。
mRNA には、RNAses(リボヌクレアーゼ)によって分解されやすいという一過性の性質と、強い免疫反応を引き起こすことでタンパク質への転写が阻害されるという2つの大きな障害があった。また、プラスミド DNA は筋肉内に6か月間残存することが確認されているが、mRNA はそれよりも早く消滅してしまうと考えられる。
ワクチンに応用する場合、当初は RNA の免疫原性が有利に働くと考えられていた。
mRNA がワクチンのアジュバントとして機能することで、アルミニウムのような毒性のある添加物を使用する必要がなくなるからだ。
しかし、免疫反応は、炎症反応だけでなく、RNA の迅速な除去と転写の抑制をもたらす。
したがって、このアイデアは実用的ではないことが判明した。
その後、mRNA がタンパク質を生成する前に分解されないようにするために、さまざまなアイデアが検討された時期があった。
その結果、ウリジンヌクレオチドの代わりにメチルプソイドウリジンを使えば、RNA が分解されずに安定化し、免疫形成に必要なタンパク質抗原を十分な量生成できるようになることがわかった(Liu, 2019)。
ワクチンで送達されるこのような形態の mRNA は、自然界では決して見られないため、未知の結果をもたらす可能性がある。
Pfizer-BioNTech と Moderna の mRNA ワクチンは、非常に類似した技術に基づいており、完全長の SARS-CoV-2 スパイクタンパク質をコードする RNA 配列を脂質ナノ粒子が包み込んでいる。
製造工程では、まずスパイクタンパクをコードする DNA 分子を組み立てる。
このプロセスは現在では商品化されているので、ヌクレオチドの配列の指定から DNA 分子を得ることは比較的容易である(Corbettら, 2020)。
RNA ポリメラーゼが触媒する酵素反応を利用して、DNA から無細胞でインビトロ転写した後、一本鎖 RNA は特定のヌクレオシド修飾によって安定化され、高度に精製される。
マサチューセッツ州ケンブリッジにある Moderna 社は、SARS-CoV-2 に対する mRNA ワクチンを開発した企業のひとつである。
Moderna 社の幹部は、この技術をさまざまな用途に拡張するという壮大なビジョンを持っている。
この技術を使えば、抗体を作るためだけでなく、遺伝病やがんなどの治療用タンパク質を体内で生成することができる。
彼らが開発しているのは、DNA が記憶素子、メッセンジャー RNA が「ソフトウェア」、そして RNA がコードするタンパク質がさまざまな応用分野を代表するような、汎用的なプラットフォームである。
そのビジョンは壮大であり、理論的に可能なアプリケーションは膨大である(Moderna, 2020)。
技術的には素晴らしいが、生命のコードを操作することは、長期的あるいは永続的に、まったく予期しない悪影響をもたらす可能性がある。
SARS-CoV-2 はプラス鎖 RNA ウイルスの一種であり、タンパク質に翻訳される前にアンチセンス鎖へのコピーを必要とするのではなく、RNA がコード化するタンパク質を直接コード化することを意味する。
ウイルスは、主に一本鎖 RNA 分子がタンパク質コートに包まれて構成されている。
このコートには、ウイルスの構造タンパク質が含まれており、特にスパイクタンパク質は、ウイルスの受容体(SARS-CoV-2 の場合は ACE2 受容体)への結合と、ウイルスの宿主細胞膜への融合を促進する。
SARS-CoV-2 のスパイクタンパク質は、中和抗体の主要な標的である。
これはクラス 1 の融合糖タンパク質であり、インフルエンザウイルスが産生するヘマグルチニンや合胞体ウイルスが産生する融合糖タンパク質、さらにはヒト免疫不全ウイルス(HIV)が産生する gp160 と類似している(Corbettら, 2020)。
mRNA ワクチンは、脂質粒子に封入された RNA をメッセンジャーとして使用する可能性を探る長年の研究の集大成である。
宿主細胞の既存の生物学的機構を利用して、mRNA からタンパク質が自然に生成されるようになっている。
この分野が発展したのは、実験室で特定のオリゴヌクレオチド DNA 配列を、生物を直接介さずに簡単に合成できるようになったからである。
この技術は商品化しており、比較的低コストで大規模に行うことができる。
また、DNA から RNA への酵素変換も簡単で、反応スープから本質的に純粋な一本鎖 RNA を分離することが可能である(Kosuri and Church, 2014)。
mRNA には、RNAses(リボヌクレアーゼ)によって分解されやすいという一過性の性質と、強い免疫反応を引き起こすことでタンパク質への転写が阻害されるという2つの大きな障害があった。また、プラスミド DNA は筋肉内に6か月間残存することが確認されているが、mRNA はそれよりも早く消滅してしまうと考えられる。
ワクチンに応用する場合、当初は RNA の免疫原性が有利に働くと考えられていた。
mRNA がワクチンのアジュバントとして機能することで、アルミニウムのような毒性のある添加物を使用する必要がなくなるからだ。
しかし、免疫反応は、炎症反応だけでなく、RNA の迅速な除去と転写の抑制をもたらす。
したがって、このアイデアは実用的ではないことが判明した。
その後、mRNA がタンパク質を生成する前に分解されないようにするために、さまざまなアイデアが検討された時期があった。
その結果、ウリジンヌクレオチドの代わりにメチルプソイドウリジンを使えば、RNA が分解されずに安定化し、免疫形成に必要なタンパク質抗原を十分な量生成できるようになることがわかった(Liu, 2019)。
ワクチンで送達されるこのような形態の mRNA は、自然界では決して見られないため、未知の結果をもたらす可能性がある。
Pfizer-BioNTech と Moderna の mRNA ワクチンは、非常に類似した技術に基づいており、完全長の SARS-CoV-2 スパイクタンパク質をコードする RNA 配列を脂質ナノ粒子が包み込んでいる。
製造工程では、まずスパイクタンパクをコードする DNA 分子を組み立てる。
このプロセスは現在では商品化されているので、ヌクレオチドの配列の指定から DNA 分子を得ることは比較的容易である(Corbettら, 2020)。
RNA ポリメラーゼが触媒する酵素反応を利用して、DNA から無細胞でインビトロ転写した後、一本鎖 RNA は特定のヌクレオシド修飾によって安定化され、高度に精製される。
マサチューセッツ州ケンブリッジにある Moderna 社は、SARS-CoV-2 に対する mRNA ワクチンを開発した企業のひとつである。
Moderna 社の幹部は、この技術をさまざまな用途に拡張するという壮大なビジョンを持っている。
この技術を使えば、抗体を作るためだけでなく、遺伝病やがんなどの治療用タンパク質を体内で生成することができる。
彼らが開発しているのは、DNA が記憶素子、メッセンジャー RNA が「ソフトウェア」、そして RNA がコードするタンパク質がさまざまな応用分野を代表するような、汎用的なプラットフォームである。
そのビジョンは壮大であり、理論的に可能なアプリケーションは膨大である(Moderna, 2020)。
技術的には素晴らしいが、生命のコードを操作することは、長期的あるいは永続的に、まったく予期しない悪影響をもたらす可能性がある。
SARS-CoV-2 はプラス鎖 RNA ウイルスの一種であり、タンパク質に翻訳される前にアンチセンス鎖へのコピーを必要とするのではなく、RNA がコード化するタンパク質を直接コード化することを意味する。
ウイルスは、主に一本鎖 RNA 分子がタンパク質コートに包まれて構成されている。
このコートには、ウイルスの構造タンパク質が含まれており、特にスパイクタンパク質は、ウイルスの受容体(SARS-CoV-2 の場合は ACE2 受容体)への結合と、ウイルスの宿主細胞膜への融合を促進する。
SARS-CoV-2 のスパイクタンパク質は、中和抗体の主要な標的である。
これはクラス 1 の融合糖タンパク質であり、インフルエンザウイルスが産生するヘマグルチニンや合胞体ウイルスが産生する融合糖タンパク質、さらにはヒト免疫不全ウイルス(HIV)が産生する gp160 と類似している(Corbettら, 2020)。
mRNA ワクチンは、脂質粒子に封入された RNA をメッセンジャーとして使用する可能性を探る長年の研究の集大成である。
宿主細胞の既存の生物学的機構を利用して、mRNA からタンパク質が自然に生成されるようになっている。
この分野が発展したのは、実験室で特定のオリゴヌクレオチド DNA 配列を、生物を直接介さずに簡単に合成できるようになったからである。
この技術は商品化しており、比較的低コストで大規模に行うことができる。
また、DNA から RNA への酵素変換も簡単で、反応スープから本質的に純粋な一本鎖 RNA を分離することが可能である(Kosuri and Church, 2014)。
原理的には単純なプロセスだが、mRNA ワクチンの製造者はいくつかの重大な技術的課題に直面している。
まず第一に、細胞外の mRNA 自体が免疫反応を引き起こし、細胞に取り込まれる前に急速に排除されてしまうことが挙げられる。
そのため、mRNA を免疫系から隠せるようなナノ粒子に封入する必要がある。
第二の課題は、細胞にナノ粒子を取り込ませることである。
これは、リン脂質をナノ粒子に組み込むことで、脂質粒子のエンドサイトーシスの自然な経路を利用することで解決できる。
三つめの問題は、RNA をタンパク質に変換する機械を活性化することである。
SARS-CoV-2 の場合、生成されるタンパク質はスパイクタンパク質である。
スパイクタンパク質の合成後、抗原提示細胞はスパイクタンパク質を T 細胞に提示する必要があり、T 細胞は最終的に防御記憶抗体を産生することになる(Moderna, 2020)。
なぜなら、ナノ粒子はほとんどが筋肉細胞に取り込まれ、筋肉細胞は動かないため、必ずしも免疫反応を起こすことができるわけではないからである。
後述するように、スパイクタンパク質は筋肉細胞で合成された後、抗原提示細胞であるマクロファージに引き渡され、マクロファージが標準的な B 細胞ベースの抗体生成カスケード反応を起こすというシナリオが考えられる。
ワクチンに含まれる mRNAは、DNA テンプレートから合成された後、いくつかの修飾ステップを経る。
これらのステップの中には、リボソームによるタンパク質への翻訳をサポートするために適切に修正された、ヒトの mRNA 配列と完全に一致するように準備するものもある。
その他の修飾は、抗体反応を引き起こすのに十分なタンパク質を生成できるように、mRNA が分解されないようにすることを目的としてる。
修飾されていないmRNAは、血清中のインターフェロン-α(IF-α)濃度を高める免疫反応を引き起こすため、好ましくない反応と考えられてる。
しかし、研究者たちは、mRNA のすべてのウリジンを N -メチル-プソイドウリジンに置き換えることで、分子の安定性が向上し、免疫原性が低下することを発見した(Kariko ら, 2008; Corbettら, 2020)。
このステップは、ワクチンの mRNA の調製の一部であるが、さらに、分子の 5' 末端に 7 -メチルグアノシンの「キャップ」が付加され、3' 末端には 100 個以上のアデニンヌクレオチドからなるポリアデニン(ポリ A)テールが付加される。
キャップとテールは、細胞質内での mRNA の安定性を維持し、タンパク質への翻訳を促進するために不可欠である(Schlake ら, 2012; Gallie, 1991)。
通常、スパイクタンパク質は、融合前の構成から融合後の構成へと非常に簡単に反転する。
このワクチンに含まれるスパイクタンパク質は、融合前の安定した状態を好むように調整されており、この状態がより強い免疫反応を引き起こすからである(Jackson ら, 2020)。
これは、S2 サブユニットの中央ヘリックスの頂点にある重要な 2 残基のセグメントを、986 位と 987 位の2つのプロリン残基に置き換える「遺伝子変異」によって行われた(Wrapp ら, 2020)。
プロリンは非常に柔軟性に欠けるアミノ酸であるため、融合状態への移行を妨げてしまう。
この修飾により、融合とそれに続く細胞への取り込みを支える重要な部位への抗体のアクセスが格段に良くなる。
しかし、このことは、ワクチンの mRNA の指示に従ってヒトの宿主細胞が産生した遺伝子組み換えスパイクタンパク質が、融合能力が損なわれているために、ACE2 受容体と結合して細胞膜に留まることを意味するのではないだろうか?
その結果、どのようなことが起こるのか?
それはわからない。
中国の研究者らは、2020 年 8 月に「Nature」誌に、SARS-CoV-2 ウイルスのさまざまな断片やタンパク質をコードする mRNA を用いたいくつかの実験的な mRNA ワクチンのデータを発表した。
研究チームは、3種類の異なるワクチン製剤を用いて、マウスに適切な免疫反応を誘導できるかどうかを検証した。
S(スパイク)、M、E の3つの構造タンパク質は、「ウイルス様粒子」(VLP)を組み立てるために最低限必要なものである。
彼らの仮説は、M と E に加えて S のスパイクタンパク質を mRNA コードに含めることで、VLP の組み立てが可能になるというものである。
これは、ワクチンナノ粒子から S タンパク質の mRNA だけを取り込んだ細胞の表面に露出した S タンパク質よりも、自然のウイルスに近い形で存在するからである。
また、M と E で増強してウイルスのような粒子を作ることができれば、スパイクタンパク質全体ではなく、スパイクタンパク質の重要な断片でも免疫を誘導できるのではないかと期待していた(Lu ら, 2020)。
彼らは、3つのタンパク質の完全な遺伝子を含むワクチンが、2回目の投与後、少なくとも8週間持続する強固な免疫反応を引き出すことを実験的に確認した。
その性能は、スパイクタンパク質のみを含むワクチンよりもはるかに優れていた。
残念なことに、スパイクタンパク質の重要な成分のみを含み、他の2つのエンベロープタンパク質で増強したワクチンは、実質的に何の反応も示さなかった。
Moderna の研究者も同様の研究を行い、同様の結果を得た。
彼らは、スパイクタンパクだけでは、3つのエンベロープタンパクをすべてコードする RNA を含む製剤に比べて明らかに劣ると結論づけ、その理由として、細胞が無傷のウイルス様粒子を放出するためには、スパイクタンパクを細胞膜に留めるだけではなく、3つのタンパクがすべて必要であるという仮説を立てた。
動物実験では、スパイクタンパクだけでは T 細胞反応が起こらなかったのに対し、3つのタンパクを含む製剤では T 細胞反応が起きた(Corbett ら, 2020)。
緊急承認された2つのワクチンにはスパイクタンパクの mRNA コードしか含まれておらず(E や M は含まれていない)、性能の低さが観察されたにもかかわらず、この決定には十分な理由があったに違いない。
これは、脂質ナノ粒子の設計をより洗練されたものにすることで(後述)、RNA を分解から守りつつ、脂質をアジュバント(従来のワクチンによく添加されているアルミニウムと同様のもの)として機能させることができたのではないかと考えられる。
RNA コードのもう一つの興味深い点は、開発者がアデニンとウラシル(As と Us)を使わずに、シトシンとグアニン(Cs と Gs)を多く使ったことである。
彼らは、このようにコドンの3番目の位置だけを、アミノ酸マップを変更しない場合にのみ置き換えるように注意している(Hubert, 2020)。
GC に富んだ mRNA 配列は、GC に乏しい配列に比べて、最大で 100 倍も効率よく発現(タンパク質に翻訳)されることが実験的に証明されている(Kudla ら, 2006)。
つまり、これはスパイクタンパク質の豊富なコピーの合成をさらに確実にするための、もう一つの修正であると考えられる。
この操作が意図しない結果をもたらすかどうかはわからない。
ウイルスを含む細胞内病原体は、宿主細胞のゲノムに比べてGC含量が低い傾向がある(Rocha and Danchin, 2020)。
そのため、この改変は、ヒトのタンパク質であるという欺瞞の効果を高めたいという動機もあったのかもしれない。
このように、RNA に施されたさまざまな改変は、RNA を分解されにくくし、よりヒトのメッセンジャー RNA のタンパク質をコードする配列に近づけ、効率的に抗原性タンパク質に翻訳することを目的としている。
まず第一に、細胞外の mRNA 自体が免疫反応を引き起こし、細胞に取り込まれる前に急速に排除されてしまうことが挙げられる。
そのため、mRNA を免疫系から隠せるようなナノ粒子に封入する必要がある。
第二の課題は、細胞にナノ粒子を取り込ませることである。
これは、リン脂質をナノ粒子に組み込むことで、脂質粒子のエンドサイトーシスの自然な経路を利用することで解決できる。
三つめの問題は、RNA をタンパク質に変換する機械を活性化することである。
SARS-CoV-2 の場合、生成されるタンパク質はスパイクタンパク質である。
スパイクタンパク質の合成後、抗原提示細胞はスパイクタンパク質を T 細胞に提示する必要があり、T 細胞は最終的に防御記憶抗体を産生することになる(Moderna, 2020)。
なぜなら、ナノ粒子はほとんどが筋肉細胞に取り込まれ、筋肉細胞は動かないため、必ずしも免疫反応を起こすことができるわけではないからである。
後述するように、スパイクタンパク質は筋肉細胞で合成された後、抗原提示細胞であるマクロファージに引き渡され、マクロファージが標準的な B 細胞ベースの抗体生成カスケード反応を起こすというシナリオが考えられる。
ワクチンに含まれる mRNAは、DNA テンプレートから合成された後、いくつかの修飾ステップを経る。
これらのステップの中には、リボソームによるタンパク質への翻訳をサポートするために適切に修正された、ヒトの mRNA 配列と完全に一致するように準備するものもある。
その他の修飾は、抗体反応を引き起こすのに十分なタンパク質を生成できるように、mRNA が分解されないようにすることを目的としてる。
修飾されていないmRNAは、血清中のインターフェロン-α(IF-α)濃度を高める免疫反応を引き起こすため、好ましくない反応と考えられてる。
しかし、研究者たちは、mRNA のすべてのウリジンを N -メチル-プソイドウリジンに置き換えることで、分子の安定性が向上し、免疫原性が低下することを発見した(Kariko ら, 2008; Corbettら, 2020)。
このステップは、ワクチンの mRNA の調製の一部であるが、さらに、分子の 5' 末端に 7 -メチルグアノシンの「キャップ」が付加され、3' 末端には 100 個以上のアデニンヌクレオチドからなるポリアデニン(ポリ A)テールが付加される。
キャップとテールは、細胞質内での mRNA の安定性を維持し、タンパク質への翻訳を促進するために不可欠である(Schlake ら, 2012; Gallie, 1991)。
通常、スパイクタンパク質は、融合前の構成から融合後の構成へと非常に簡単に反転する。
このワクチンに含まれるスパイクタンパク質は、融合前の安定した状態を好むように調整されており、この状態がより強い免疫反応を引き起こすからである(Jackson ら, 2020)。
これは、S2 サブユニットの中央ヘリックスの頂点にある重要な 2 残基のセグメントを、986 位と 987 位の2つのプロリン残基に置き換える「遺伝子変異」によって行われた(Wrapp ら, 2020)。
プロリンは非常に柔軟性に欠けるアミノ酸であるため、融合状態への移行を妨げてしまう。
この修飾により、融合とそれに続く細胞への取り込みを支える重要な部位への抗体のアクセスが格段に良くなる。
しかし、このことは、ワクチンの mRNA の指示に従ってヒトの宿主細胞が産生した遺伝子組み換えスパイクタンパク質が、融合能力が損なわれているために、ACE2 受容体と結合して細胞膜に留まることを意味するのではないだろうか?
その結果、どのようなことが起こるのか?
それはわからない。
中国の研究者らは、2020 年 8 月に「Nature」誌に、SARS-CoV-2 ウイルスのさまざまな断片やタンパク質をコードする mRNA を用いたいくつかの実験的な mRNA ワクチンのデータを発表した。
研究チームは、3種類の異なるワクチン製剤を用いて、マウスに適切な免疫反応を誘導できるかどうかを検証した。
S(スパイク)、M、E の3つの構造タンパク質は、「ウイルス様粒子」(VLP)を組み立てるために最低限必要なものである。
彼らの仮説は、M と E に加えて S のスパイクタンパク質を mRNA コードに含めることで、VLP の組み立てが可能になるというものである。
これは、ワクチンナノ粒子から S タンパク質の mRNA だけを取り込んだ細胞の表面に露出した S タンパク質よりも、自然のウイルスに近い形で存在するからである。
また、M と E で増強してウイルスのような粒子を作ることができれば、スパイクタンパク質全体ではなく、スパイクタンパク質の重要な断片でも免疫を誘導できるのではないかと期待していた(Lu ら, 2020)。
彼らは、3つのタンパク質の完全な遺伝子を含むワクチンが、2回目の投与後、少なくとも8週間持続する強固な免疫反応を引き出すことを実験的に確認した。
その性能は、スパイクタンパク質のみを含むワクチンよりもはるかに優れていた。
残念なことに、スパイクタンパク質の重要な成分のみを含み、他の2つのエンベロープタンパク質で増強したワクチンは、実質的に何の反応も示さなかった。
Moderna の研究者も同様の研究を行い、同様の結果を得た。
彼らは、スパイクタンパクだけでは、3つのエンベロープタンパクをすべてコードする RNA を含む製剤に比べて明らかに劣ると結論づけ、その理由として、細胞が無傷のウイルス様粒子を放出するためには、スパイクタンパクを細胞膜に留めるだけではなく、3つのタンパクがすべて必要であるという仮説を立てた。
動物実験では、スパイクタンパクだけでは T 細胞反応が起こらなかったのに対し、3つのタンパクを含む製剤では T 細胞反応が起きた(Corbett ら, 2020)。
緊急承認された2つのワクチンにはスパイクタンパクの mRNA コードしか含まれておらず(E や M は含まれていない)、性能の低さが観察されたにもかかわらず、この決定には十分な理由があったに違いない。
これは、脂質ナノ粒子の設計をより洗練されたものにすることで(後述)、RNA を分解から守りつつ、脂質をアジュバント(従来のワクチンによく添加されているアルミニウムと同様のもの)として機能させることができたのではないかと考えられる。
RNA コードのもう一つの興味深い点は、開発者がアデニンとウラシル(As と Us)を使わずに、シトシンとグアニン(Cs と Gs)を多く使ったことである。
彼らは、このようにコドンの3番目の位置だけを、アミノ酸マップを変更しない場合にのみ置き換えるように注意している(Hubert, 2020)。
GC に富んだ mRNA 配列は、GC に乏しい配列に比べて、最大で 100 倍も効率よく発現(タンパク質に翻訳)されることが実験的に証明されている(Kudla ら, 2006)。
つまり、これはスパイクタンパク質の豊富なコピーの合成をさらに確実にするための、もう一つの修正であると考えられる。
この操作が意図しない結果をもたらすかどうかはわからない。
ウイルスを含む細胞内病原体は、宿主細胞のゲノムに比べてGC含量が低い傾向がある(Rocha and Danchin, 2020)。
そのため、この改変は、ヒトのタンパク質であるという欺瞞の効果を高めたいという動機もあったのかもしれない。
このように、RNA に施されたさまざまな改変は、RNA を分解されにくくし、よりヒトのメッセンジャー RNA のタンパク質をコードする配列に近づけ、効率的に抗原性タンパク質に翻訳することを目的としている。
リポソームとしても知られる脂質ナノ粒子(LNP)は、RNA 分子をカプセル化し、リボヌクレアーゼによる酵素分解から保護することができるため、送達方法を成功させるための必須要素を形成している(Wadhwa ら, 2020; Xu ら, 2020)。これらの人工構築物は、エクソソームによく似ている。エクソソームは、細胞から分泌され、隣の細胞に取り込まれる細胞外小胞であり、また、しばしば DNA や RNA を内包している。したがって、これらのナノ粒子は、通常、細胞外のエクソソームをエンドソームに内包する自然なエンドサイトーシスのプロセスを利用することができる。エンドソームが酸性化してリソソームになると、mRNA が細胞質に放出され、ここでタンパク質への翻訳が行われる。リポソームは、ウイルスベースのワクチンをカプセル化した融合タンパク質と比較して、抗原提示と樹状細胞の成熟を高めることに成功していることが実際に判明している(Norling ら, 2019)。
これらのワクチンの脂質ナノ粒子(LNP)は、イオン化可能なカチオン性脂質、リン脂質、コレステロール、およびポリエチレングリコール(PEG)で構成されている。この混合物は、mRNA 分子の周りに安定した脂質二重層を形成する。これらの実験的ワクチンに含まれるリン脂質は、ホスファチジルコリンの頭部にグリセロールリンカーを介して2つの飽和アルキル尾部が結合している。今回のワクチンに使用されている脂質は、1,2-ジステアロイル-sn-グリセロ-3-ホスホコリン(DSPC)と呼ばれ、18 個の繰り返し炭素単位を持つ。比較的長い鎖は、液相ではなくゲル相を形成する傾向がある。鎖が短い分子(炭素数 12 の鎖など)は、代わりに流動相にとどまる傾向がある。DSPC を用いたゲル相リポソームは、長いアルキル鎖が脂質ドメイン内での動きを制限するため、RNA を分解から守るのに優れた性能を発揮することが分かっている。また、アジュバントとしての効果も高く、曝露した細胞からサイトカインである腫瘍壊死因子-α(TNF-α)、インターロイキン(IL)-6、IL-1β の放出を増加させることがわかっている(Norling ら, 2019)。しかし、炎症反応を誘発する能力は、人々が経験している痛み、腫れ、発熱、眠気などの多くの症状の原因となっている可能性がある。bioRxiv に掲載された研究では、脂質ナノ粒子に含まれるこれらのイオン化可能なカチオン性脂質が、マウスに強い炎症反応を誘発することが実験的に検証されている(Ndeupen ら, 2021)。
現在の mRNA ワクチンは、筋肉内注射によって投与される。筋肉には血管の大きなネットワークがあり、免疫細胞を注射部位にリクルートすることができる(Zeng ら, 2020)。一般的に筋肉細胞は、アジュバントに反応して免疫細胞が浸潤すると、免疫反応を促進することができる(Marino ら, 2011)。マウスに投与した mRNA ワクチンに対する反応を慎重に分析した結果、抗原は最初に筋肉細胞内で発現し、その後、抗原提示細胞に移行することが明らかになり、CD8 T 細胞反応を開始するための主要な経路として「クロスプライミング」が示唆された(Lazzaro ら,2015)。筋細胞は、誤って折り畳まれたヒトタンパク質に対処するために通常使用される免疫反応を利用していると推測することができる。そのようなタンパク質は、主要組織適合性複合体(MHC)クラス II タンパク質のアップレギュレーションを誘導し、クラス II タンパク質は、ミスフォールドしたタンパク質に結合し、細胞膜に無傷で輸送する(Jiang ら,2013)。
そして、MHC に結合した表面タンパク質が炎症反応を引き起こし、その後、抗原提示細胞(樹状細胞やマクロファージなど)が筋肉組織に浸潤し、抗原提示細胞は提示されたタンパク質を取り込んでリンパ系に運び、T 細胞に提示する。これらの T 細胞は、最終的にそのタンパク質に特異的な記憶抗体を産生するカスケードを開始することができる。筋細胞はMHCクラスIIタンパク質を発現している(Cifuentes-Diazら、1992年)。クラスIとは対照的に、クラス II MHC タンパク質は、タンパク質の部分的な分解に由来する小さなペプチド配列ではなく、無傷のタンパク質を表面に輸送することに特化している(Jiang ら, 2013)
ヒト以外の霊長類を対象としたin vitro 研究では、放射性同位元素で標識された mRNA が注射部位からリンパ節に移動し、少なくとも 28 時間はそこに留まることが示された。筋肉組織および排出リンパ節の両方に存在する抗原提示細胞(APC)が放射性標識 mRNA を含むことが示された(Lindsay ら, 2019)。古典的なAPCには、樹状細胞、マクロファージ、ランゲルハンス細胞(皮膚にある)、B細胞などがある。これらのワクチンに関連する副作用の多くは、免疫細胞の急速な浸潤を考えると予想されるように、注射部位の痛みや炎症を伴う。
リンパ節腫脹とは、リンパ節の腫れを伴うリンパ系の炎症状態のことである。腕の穴のリンパ節が腫れること(腋窩リンパ節腫脹)は、転移性乳がんの特徴である。2021 年に発表された論文では、SARS-CoV-2 ワクチン接種後に腋窩リンパ節腫脹を発症した女性の4例が紹介されている(Mehta ら, 2021)。著者らはこの症状を、乳がんの可能性があるため生検による経過観察が必要な指標と誤解しないように注意を促している。この症状は、mRNA ワクチンが主に APC に取り込まれ、APC は mRNA から抗原(スパイクタンパク)を合成し、膜上にスパイクタンパクを表示しながらリンパ系に移行すると推定されることを示すトレーサー研究を裏付けるものである。
FDA が報告した Pfizer-BioNTech の臨床試験中に経験した最も一般的な副作用のリストには、「注射部位の痛み、疲労、頭痛、筋肉痛、悪寒、関節痛、発熱、注射部位の腫れ、注射部位の赤発、吐き気、倦怠感、リンパ節腫脹」などが含まれている(米国食品医薬品局, 2021)。次に、これらの mRNA ワクチンで生じる個々の分子および臓器系の懸念について説明します。
これらのワクチンの脂質ナノ粒子(LNP)は、イオン化可能なカチオン性脂質、リン脂質、コレステロール、およびポリエチレングリコール(PEG)で構成されている。この混合物は、mRNA 分子の周りに安定した脂質二重層を形成する。これらの実験的ワクチンに含まれるリン脂質は、ホスファチジルコリンの頭部にグリセロールリンカーを介して2つの飽和アルキル尾部が結合している。今回のワクチンに使用されている脂質は、1,2-ジステアロイル-sn-グリセロ-3-ホスホコリン(DSPC)と呼ばれ、18 個の繰り返し炭素単位を持つ。比較的長い鎖は、液相ではなくゲル相を形成する傾向がある。鎖が短い分子(炭素数 12 の鎖など)は、代わりに流動相にとどまる傾向がある。DSPC を用いたゲル相リポソームは、長いアルキル鎖が脂質ドメイン内での動きを制限するため、RNA を分解から守るのに優れた性能を発揮することが分かっている。また、アジュバントとしての効果も高く、曝露した細胞からサイトカインである腫瘍壊死因子-α(TNF-α)、インターロイキン(IL)-6、IL-1β の放出を増加させることがわかっている(Norling ら, 2019)。しかし、炎症反応を誘発する能力は、人々が経験している痛み、腫れ、発熱、眠気などの多くの症状の原因となっている可能性がある。bioRxiv に掲載された研究では、脂質ナノ粒子に含まれるこれらのイオン化可能なカチオン性脂質が、マウスに強い炎症反応を誘発することが実験的に検証されている(Ndeupen ら, 2021)。
現在の mRNA ワクチンは、筋肉内注射によって投与される。筋肉には血管の大きなネットワークがあり、免疫細胞を注射部位にリクルートすることができる(Zeng ら, 2020)。一般的に筋肉細胞は、アジュバントに反応して免疫細胞が浸潤すると、免疫反応を促進することができる(Marino ら, 2011)。マウスに投与した mRNA ワクチンに対する反応を慎重に分析した結果、抗原は最初に筋肉細胞内で発現し、その後、抗原提示細胞に移行することが明らかになり、CD8 T 細胞反応を開始するための主要な経路として「クロスプライミング」が示唆された(Lazzaro ら,2015)。筋細胞は、誤って折り畳まれたヒトタンパク質に対処するために通常使用される免疫反応を利用していると推測することができる。そのようなタンパク質は、主要組織適合性複合体(MHC)クラス II タンパク質のアップレギュレーションを誘導し、クラス II タンパク質は、ミスフォールドしたタンパク質に結合し、細胞膜に無傷で輸送する(Jiang ら,2013)。
そして、MHC に結合した表面タンパク質が炎症反応を引き起こし、その後、抗原提示細胞(樹状細胞やマクロファージなど)が筋肉組織に浸潤し、抗原提示細胞は提示されたタンパク質を取り込んでリンパ系に運び、T 細胞に提示する。これらの T 細胞は、最終的にそのタンパク質に特異的な記憶抗体を産生するカスケードを開始することができる。筋細胞はMHCクラスIIタンパク質を発現している(Cifuentes-Diazら、1992年)。クラスIとは対照的に、クラス II MHC タンパク質は、タンパク質の部分的な分解に由来する小さなペプチド配列ではなく、無傷のタンパク質を表面に輸送することに特化している(Jiang ら, 2013)
ヒト以外の霊長類を対象としたin vitro 研究では、放射性同位元素で標識された mRNA が注射部位からリンパ節に移動し、少なくとも 28 時間はそこに留まることが示された。筋肉組織および排出リンパ節の両方に存在する抗原提示細胞(APC)が放射性標識 mRNA を含むことが示された(Lindsay ら, 2019)。古典的なAPCには、樹状細胞、マクロファージ、ランゲルハンス細胞(皮膚にある)、B細胞などがある。これらのワクチンに関連する副作用の多くは、免疫細胞の急速な浸潤を考えると予想されるように、注射部位の痛みや炎症を伴う。
リンパ節腫脹とは、リンパ節の腫れを伴うリンパ系の炎症状態のことである。腕の穴のリンパ節が腫れること(腋窩リンパ節腫脹)は、転移性乳がんの特徴である。2021 年に発表された論文では、SARS-CoV-2 ワクチン接種後に腋窩リンパ節腫脹を発症した女性の4例が紹介されている(Mehta ら, 2021)。著者らはこの症状を、乳がんの可能性があるため生検による経過観察が必要な指標と誤解しないように注意を促している。この症状は、mRNA ワクチンが主に APC に取り込まれ、APC は mRNA から抗原(スパイクタンパク)を合成し、膜上にスパイクタンパクを表示しながらリンパ系に移行すると推定されることを示すトレーサー研究を裏付けるものである。
FDA が報告した Pfizer-BioNTech の臨床試験中に経験した最も一般的な副作用のリストには、「注射部位の痛み、疲労、頭痛、筋肉痛、悪寒、関節痛、発熱、注射部位の腫れ、注射部位の赤発、吐き気、倦怠感、リンパ節腫脹」などが含まれている(米国食品医薬品局, 2021)。次に、これらの mRNA ワクチンで生じる個々の分子および臓器系の懸念について説明します。
アジュバントは、添加されたワクチンから「免疫反応の方向性、持続時間、強さに関する独特の免疫学的プロファイルを引き出す」ことを目的としたワクチン添加物である(Liang ら, 2020)。ミョウバンやその他のアルミニウム化合物は、従来のワクチンで最も一般的に使用されており、注射部位の間質細胞の活性化だけでなく、幅広い全身の免疫活性化経路を誘発する(Lambrecht ら, 2009、Danielsson & Eriksson, 2021)。
アルミニウムベースのアジュバントは、コロナウイルスワクチンには最適ではないと判断されたため、他の解決策が模索された(Liang ら, 2020)。
その結果、広く使われている医薬品成分のポリエチレングリコール(PEG)という形で解決策が示されました。核酸ベースのワクチンを使用する際の制限要因は、核酸がヌクレアーゼ酵素によってすぐに分解される傾向があることである(Ho et al.2021)。注入された mRNA を標的とする RNAse 酵素については、これらの酵素は、細胞内(主にリソソーム内)(Fujiwaraら, 2017)および細胞外(Luら, 2018)の両方に広く分布している。この制限を克服するために、COVID-19 に対して現在展開されている両方の mRNA ワクチンは、送達媒体として脂質ベースのナノ粒子を利用している。mRNA カーゴは、合成脂質とコレステロールで構成されたシェルの中に、分解に対して mRNA 分子を安定化させるための PEG とともに入れられている。
Pfizer / BioNTech が製造したワクチンは、2-[(ポリエチレングリコール)-2000]-N, N-ジテトラデシルアセトアミド、または ALC-0159 からナノ粒子を作成しており、一般的には単に PEG と略されている(世界保健機関, 2021/1/14)。Moderna ワクチンには、もう一つの PEG 変種である SM-102、1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol2000 が含まれている(世界保健機関, 2021/1/19)。便宜上、両方の PEG 修飾脂質を PEG と略記し、標準的な命名法に従ってワクチンを PEG 化したものと呼ぶことにする。
脂質シェルは3つの役割を果たしている。まず、細胞に取り込まれる前に、遺伝物質を分解から守る。次に、コレステロールを含む脂質シェルは、細胞の脂質膜との融合と、それに続く脂質粒子のエンドサイトーシスによって、自然に存在するプロセスを呼び起こし、細胞への取り込みを促進する。そして最後に、アジュバントとして作用する(Ho ら, 2021)。注射療法における PEG の広範な使用に関して最も懸念されているのは、この後者の免疫刺激剤としての役割である。
これらのPEG化ワクチンを含む大規模な臨床試験に先立ち、2019年5月に発表された論文の中で、Mohamed et. (2019)は、PEGおよびそれがもたらすことが示されていた免疫学的活性化(体液性、細胞媒介性、および補体ベースの活性化を含む)に関する多くの気になる知見を記載しています。彼らは、逆説的に、大量のPEGの注射量は明らかなアレルギー反応を引き起こさないことを指摘している。しかし、少量であれば、劇的な病的免疫活性化を引き起こすことができる。PEG化を利用したワクチンは、マイクロモル量のこれらの脂質を利用しており、この潜在的な免疫原性の低用量暴露を構成している。動物実験では、補体の活性化がアナフィラキシーや心血管虚脱の原因となることが示されており、ヒトにおいても注射されたPEGは複数の補体経路を活性化する。ある研究の著者は、「二次メディエーターのこのカスケードは、エフェクター免疫反応を大幅に増幅し、敏感な人にアナフィラキシーを誘発する可能性がある」と指摘して締めくくっています。実際、豚を用いた最近の研究では、全身性の補体活性化(例えば、PEG化リポソームの静脈内注射後に誘発される)が、C5aが原因となった心臓アナフィラキシーの原因となりうることが示されています」。(Hamad et al., 2008) また、ブタにおけるアナフィラクトイドショックは、1回目の注射による曝露ではなく、2回目の注射による曝露の後に発生したことも重要である(Kozma et al., 2019)。PEGに対する抗体の存在は、人口の中で広まっている(Zhou et al., 2020)。Yang and Lai(2015)は、調査した血液サンプルの約42%に抗PEG抗体が含まれていることを発見し、これらは導入されたPEGベースの治療薬に重要な結果をもたらす可能性があると警告している。Hong et al. (2020)は、PEGベースの医療療法にさらされたことのない集団において、最大72%の有病率を持つ抗PEG抗体を発見した。ライラら(Lila et.al. (2018)は、"このような抗PEG抗体の存在は、PEG化されたベースの治療薬を採用しているいくつかの臨床環境において、重篤な副作用の発生と同時に治療効果の障害と密接に関連している "と指摘している。ワクチンに対するアナフィラキシーは、1990年に米国疾病管理予防センターがワクチンに関連する有害事象の報告のために設立したデータベースであるVAERSに報告されたそのような事象の頻度に基づいて、以前は稀であると想定されていました(Centers for Disease Control and Prevention, 1990; Su et al.、2019)。 まれではありますが、アナフィラキシーは生命を脅かす可能性があるため、ワクチン接種後の短い期間にその可能性を監視することが重要です(McNeil et al.、2016)。
Sellaturayらは、PEG曝露に関連したアナフィラキシーの5例(うち1例は心停止を伴う瀕死の状態)を検討した後、「PEGは高リスクの『隠れた』アレルゲンであり、通常は疑われず、不注意な再曝露により頻繁にアレルギー反応を引き起こす可能性がある」と書いている。アレルギー調査はアナフィラキシーのリスクを伴い、薬物アレルギー専門センターでのみ実施されるべきである」と述べています。(Sellaturay et al., 2020)とあります。実際に、PEGに対する既存の抗体が、再曝露時のより一般的でより重篤な反応と関連していることがすでに実証されています(Gansonら、2016年)。PEG曝露時のアナフィラキシーは、公衆衛生に関連する頻度で起こっているのでしょうか?現在、多くの研究がこの現象を記録しています(Leeら、2015年、Povsicら、2016年、Wylonら、2016年)。mRNAワクチンに対するアナフィラキシー反応は、メディアで広く報道されており(Kelso, 2021)、上述のようにVAERSデータベースにも頻繁に報告されています(2021年1月29日までにSARS-CoV-2ワクチン接種後のアナフィラキシーが690件報告されています)。また、査読付きの文献に発表された初期のケーススタディもあります(Garvey & Nasser, 2020; CDC COVID-19 Response Team, 2021, January 15)。このCOVID-19ワクチン以前のワクチンに対するアナフィラキシー反応は、一般的に100万回の接種あたり2例以下の割合で報告されていましたが(McNeilら、2016年)、COVID-19ワクチン接種による現在の割合は100万回あたり11例以上であるとCDCによって報告されています(CDC COVID-19 Response Team、2021年、1月29日)。しかし、64,900人の医療従事者を対象に、初回のmRNAワクチン接種に対する反応を注意深く観察した前向き研究が発表されており、その結果、対象者の2.1%が急性アレルギー反応を報告していることがわかりました。アナフィラキシーを伴うより極端な反応は、100万回のワクチン接種につき247件発生しました(Blumenthalら、2021年)。これは、CDCが当初報告した数の21倍以上にあたります。2回目の注射では、さらに多くのアナフィラキシー反応が発生すると考えられます。
アルミニウムベースのアジュバントは、コロナウイルスワクチンには最適ではないと判断されたため、他の解決策が模索された(Liang ら, 2020)。
その結果、広く使われている医薬品成分のポリエチレングリコール(PEG)という形で解決策が示されました。核酸ベースのワクチンを使用する際の制限要因は、核酸がヌクレアーゼ酵素によってすぐに分解される傾向があることである(Ho et al.2021)。注入された mRNA を標的とする RNAse 酵素については、これらの酵素は、細胞内(主にリソソーム内)(Fujiwaraら, 2017)および細胞外(Luら, 2018)の両方に広く分布している。この制限を克服するために、COVID-19 に対して現在展開されている両方の mRNA ワクチンは、送達媒体として脂質ベースのナノ粒子を利用している。mRNA カーゴは、合成脂質とコレステロールで構成されたシェルの中に、分解に対して mRNA 分子を安定化させるための PEG とともに入れられている。
Pfizer / BioNTech が製造したワクチンは、2-[(ポリエチレングリコール)-2000]-N, N-ジテトラデシルアセトアミド、または ALC-0159 からナノ粒子を作成しており、一般的には単に PEG と略されている(世界保健機関, 2021/1/14)。Moderna ワクチンには、もう一つの PEG 変種である SM-102、1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol2000 が含まれている(世界保健機関, 2021/1/19)。便宜上、両方の PEG 修飾脂質を PEG と略記し、標準的な命名法に従ってワクチンを PEG 化したものと呼ぶことにする。
脂質シェルは3つの役割を果たしている。まず、細胞に取り込まれる前に、遺伝物質を分解から守る。次に、コレステロールを含む脂質シェルは、細胞の脂質膜との融合と、それに続く脂質粒子のエンドサイトーシスによって、自然に存在するプロセスを呼び起こし、細胞への取り込みを促進する。そして最後に、アジュバントとして作用する(Ho ら, 2021)。注射療法における PEG の広範な使用に関して最も懸念されているのは、この後者の免疫刺激剤としての役割である。
これらのPEG化ワクチンを含む大規模な臨床試験に先立ち、2019年5月に発表された論文の中で、Mohamed et. (2019)は、PEGおよびそれがもたらすことが示されていた免疫学的活性化(体液性、細胞媒介性、および補体ベースの活性化を含む)に関する多くの気になる知見を記載しています。彼らは、逆説的に、大量のPEGの注射量は明らかなアレルギー反応を引き起こさないことを指摘している。しかし、少量であれば、劇的な病的免疫活性化を引き起こすことができる。PEG化を利用したワクチンは、マイクロモル量のこれらの脂質を利用しており、この潜在的な免疫原性の低用量暴露を構成している。動物実験では、補体の活性化がアナフィラキシーや心血管虚脱の原因となることが示されており、ヒトにおいても注射されたPEGは複数の補体経路を活性化する。ある研究の著者は、「二次メディエーターのこのカスケードは、エフェクター免疫反応を大幅に増幅し、敏感な人にアナフィラキシーを誘発する可能性がある」と指摘して締めくくっています。実際、豚を用いた最近の研究では、全身性の補体活性化(例えば、PEG化リポソームの静脈内注射後に誘発される)が、C5aが原因となった心臓アナフィラキシーの原因となりうることが示されています」。(Hamad et al., 2008) また、ブタにおけるアナフィラクトイドショックは、1回目の注射による曝露ではなく、2回目の注射による曝露の後に発生したことも重要である(Kozma et al., 2019)。PEGに対する抗体の存在は、人口の中で広まっている(Zhou et al., 2020)。Yang and Lai(2015)は、調査した血液サンプルの約42%に抗PEG抗体が含まれていることを発見し、これらは導入されたPEGベースの治療薬に重要な結果をもたらす可能性があると警告している。Hong et al. (2020)は、PEGベースの医療療法にさらされたことのない集団において、最大72%の有病率を持つ抗PEG抗体を発見した。ライラら(Lila et.al. (2018)は、"このような抗PEG抗体の存在は、PEG化されたベースの治療薬を採用しているいくつかの臨床環境において、重篤な副作用の発生と同時に治療効果の障害と密接に関連している "と指摘している。ワクチンに対するアナフィラキシーは、1990年に米国疾病管理予防センターがワクチンに関連する有害事象の報告のために設立したデータベースであるVAERSに報告されたそのような事象の頻度に基づいて、以前は稀であると想定されていました(Centers for Disease Control and Prevention, 1990; Su et al.、2019)。 まれではありますが、アナフィラキシーは生命を脅かす可能性があるため、ワクチン接種後の短い期間にその可能性を監視することが重要です(McNeil et al.、2016)。
Sellaturayらは、PEG曝露に関連したアナフィラキシーの5例(うち1例は心停止を伴う瀕死の状態)を検討した後、「PEGは高リスクの『隠れた』アレルゲンであり、通常は疑われず、不注意な再曝露により頻繁にアレルギー反応を引き起こす可能性がある」と書いている。アレルギー調査はアナフィラキシーのリスクを伴い、薬物アレルギー専門センターでのみ実施されるべきである」と述べています。(Sellaturay et al., 2020)とあります。実際に、PEGに対する既存の抗体が、再曝露時のより一般的でより重篤な反応と関連していることがすでに実証されています(Gansonら、2016年)。PEG曝露時のアナフィラキシーは、公衆衛生に関連する頻度で起こっているのでしょうか?現在、多くの研究がこの現象を記録しています(Leeら、2015年、Povsicら、2016年、Wylonら、2016年)。mRNAワクチンに対するアナフィラキシー反応は、メディアで広く報道されており(Kelso, 2021)、上述のようにVAERSデータベースにも頻繁に報告されています(2021年1月29日までにSARS-CoV-2ワクチン接種後のアナフィラキシーが690件報告されています)。また、査読付きの文献に発表された初期のケーススタディもあります(Garvey & Nasser, 2020; CDC COVID-19 Response Team, 2021, January 15)。このCOVID-19ワクチン以前のワクチンに対するアナフィラキシー反応は、一般的に100万回の接種あたり2例以下の割合で報告されていましたが(McNeilら、2016年)、COVID-19ワクチン接種による現在の割合は100万回あたり11例以上であるとCDCによって報告されています(CDC COVID-19 Response Team、2021年、1月29日)。しかし、64,900人の医療従事者を対象に、初回のmRNAワクチン接種に対する反応を注意深く観察した前向き研究が発表されており、その結果、対象者の2.1%が急性アレルギー反応を報告していることがわかりました。アナフィラキシーを伴うより極端な反応は、100万回のワクチン接種につき247件発生しました(Blumenthalら、2021年)。これは、CDCが当初報告した数の21倍以上にあたります。2回目の注射では、さらに多くのアナフィラキシー反応が発生すると考えられます。
ADE は、1964 年に初めて報告された免疫学的現象である(Hawkes ら、1964 年)。この論文でホークスは、フラビウイルスの培養液を、それらのウイルスに対する高力価の抗体を含む鳥類の血清とインキュベートする一連の実験について説明している。予想外だったのは、抗体を含む血清の希釈率を高くすると、細胞の感染力が高まるということだった。抗体が感染症の中和に直接的および間接的に関与する経路は、複数提案されている(Lu et al.、2018b)。ADEは、感染時にウイルスに対する特異抗体または交差反応性抗体のいずれかの中和しない低レベルの抗体が存在する場合に起こりうる特殊なケースである。これらの抗体は、過去にウイルスにさらされたこと、関連するウイルスにさらされたこと、またはウイルスに対するワクチン接種を受けたことによって存在する可能性があります。再感染時には、ウイルスを中和するには不十分な数の抗体が、それでもウイルスに結合する。ADEは、過去にデング熱に感染したことのある人にしばしば見られる重症化の原因と考えられており(Beltramelloら、2010年)、また、過去にデング熱のワクチンを接種した人の重症化にも関与している可能性がある(Shuklaら、2020年)。ADEはまた、エボラ出血熱(Takada et al., 2003)、ジカウイルス感染症(Bardina et al., 2017)、およびその他のフラビウイルス感染症においても役割を果たしていると考えられています(Campos et al., 2020)。
Nature Biotechnology誌に掲載されたEroshenkoらの通信記事では、SARS-CoV-2に対するワクチン接種でADEが発現する可能性を示唆する証拠を包括的にレビューしています。重要なのは、in vitroとin vivomodelsの両方で試験されたコロナウイルスワクチンでADEが観察されていることです(Eroshenko et al., 2020)。また、SARS-CoV-2ワクチンでも同様の可能性があることを警告しています。SARS-CoV-2ワクチンを接種した場合にADEが起こる可能性についての理論では、非中和抗体がウイルス抗原と免疫複合体を形成し、炎症性サイトカインの過剰分泌を引き起こし、極端な場合にはサイトカインストームにより局所的な組織損傷が広範囲に及ぶことが示唆されています(Lee et al. SARS-CoV-2ワクチンに関連する可能性のあるADEについてのある広範なレビューでは、「現時点では、抗体、T細胞、または内在的な宿主の反応を測定することによって、いかなる重度のウイルス感染も免疫強化疾患と区別することができる既知の臨床所見、免疫学的アッセイまたはバイオマーカーは存在しない」と指摘しています(Arvin et al.2020; Liu et al.,2019)。この点については以下で再び触れます。事前のワクチン接種によって誘導された既存の免疫グロブリンG(IgG)抗体は、マカクのSARS-CoVによる重度の肺障害に寄与している(Liu et al.2019)。PeronとNakaya(2020)は、高齢者が経験するコロナウイルスへの過去の曝露がはるかに多様であることが、SARS-CoV-2に曝露した際にADEを起こしやすくする可能性を示唆する証拠を示している。重度のCOVID-19病から回復した患者の76%の血漿を、SARS-CoV-2と感受性細胞の培養液に加えると、Raji細胞へのSARS-CoV-2ウイルス感染能力が向上したことを報告したプレプリント論文がある(Wuら、2020年)。著者は、「COVID-19の高齢患者では(スパイクタンパク質に対する)抗体価が高く、より強い抗体反応は、患者のウイルスクリアランスの遅れや病気の重症度の増加と関連していた」と述べている。したがって、Sタンパク質特異的抗体がSARS-CoV-2感染時の疾患重症化に寄与していると推測するのは妥当である。" (Wu et al., 2020)米国のワクチンメーカー3社(Moderna、Pfizer、Johnson & Johnson)はすべて、ブースター注射の開発に取り組んでいると報告されています(Zaman 2021)。現在、何千万人もの若年成人や子供でさえも、ワクチンによってコロナウイルスのスパイクタンパク質の抗体を持っているため、この若年層の間で、将来のSARS-CoV-2感染やブースター注射に関連したADEが引き起こされる可能性があります。時間が解決してくれるでしょう。mRNAワクチンは、最終的に抗原性の高いスパイクタンパク質を抗原提示細胞に届けます。そのため、スパイクタンパクに対するモノクローナル抗体は、現在展開されているmRNAワクチンに期待される成果です。ヒトのスパイクタンパク質のモノクローナル抗体は、内因性のヒトタンパク質に対して高レベルの交差反応性抗体を産生することが判明しています(Vojdani et al.、2021年、詳細は後述)。ここでは部分的にしかレビューしていないが、スパイクタンパクに対する抗体が、以前のSARS-CoV-2感染またはワクチン接種によって誘発されるADEに寄与することを疑う十分な理由があり、それは急性または慢性の自己免疫および炎症状態として現れる可能性がある。ADEによる疾患の発現と、真の非ADEウイルス感染とを区別することは不可能であることを、我々は上述した。この観点から、mRNAワクチンを接種した直後に疾患や死亡が発生した場合、十分な調査を行っても、ワクチン反応が近因ではないと確定的に判断することはできないことを認識することが重要です。
Nature Biotechnology誌に掲載されたEroshenkoらの通信記事では、SARS-CoV-2に対するワクチン接種でADEが発現する可能性を示唆する証拠を包括的にレビューしています。重要なのは、in vitroとin vivomodelsの両方で試験されたコロナウイルスワクチンでADEが観察されていることです(Eroshenko et al., 2020)。また、SARS-CoV-2ワクチンでも同様の可能性があることを警告しています。SARS-CoV-2ワクチンを接種した場合にADEが起こる可能性についての理論では、非中和抗体がウイルス抗原と免疫複合体を形成し、炎症性サイトカインの過剰分泌を引き起こし、極端な場合にはサイトカインストームにより局所的な組織損傷が広範囲に及ぶことが示唆されています(Lee et al. SARS-CoV-2ワクチンに関連する可能性のあるADEについてのある広範なレビューでは、「現時点では、抗体、T細胞、または内在的な宿主の反応を測定することによって、いかなる重度のウイルス感染も免疫強化疾患と区別することができる既知の臨床所見、免疫学的アッセイまたはバイオマーカーは存在しない」と指摘しています(Arvin et al.2020; Liu et al.,2019)。この点については以下で再び触れます。事前のワクチン接種によって誘導された既存の免疫グロブリンG(IgG)抗体は、マカクのSARS-CoVによる重度の肺障害に寄与している(Liu et al.2019)。PeronとNakaya(2020)は、高齢者が経験するコロナウイルスへの過去の曝露がはるかに多様であることが、SARS-CoV-2に曝露した際にADEを起こしやすくする可能性を示唆する証拠を示している。重度のCOVID-19病から回復した患者の76%の血漿を、SARS-CoV-2と感受性細胞の培養液に加えると、Raji細胞へのSARS-CoV-2ウイルス感染能力が向上したことを報告したプレプリント論文がある(Wuら、2020年)。著者は、「COVID-19の高齢患者では(スパイクタンパク質に対する)抗体価が高く、より強い抗体反応は、患者のウイルスクリアランスの遅れや病気の重症度の増加と関連していた」と述べている。したがって、Sタンパク質特異的抗体がSARS-CoV-2感染時の疾患重症化に寄与していると推測するのは妥当である。" (Wu et al., 2020)米国のワクチンメーカー3社(Moderna、Pfizer、Johnson & Johnson)はすべて、ブースター注射の開発に取り組んでいると報告されています(Zaman 2021)。現在、何千万人もの若年成人や子供でさえも、ワクチンによってコロナウイルスのスパイクタンパク質の抗体を持っているため、この若年層の間で、将来のSARS-CoV-2感染やブースター注射に関連したADEが引き起こされる可能性があります。時間が解決してくれるでしょう。mRNAワクチンは、最終的に抗原性の高いスパイクタンパク質を抗原提示細胞に届けます。そのため、スパイクタンパクに対するモノクローナル抗体は、現在展開されているmRNAワクチンに期待される成果です。ヒトのスパイクタンパク質のモノクローナル抗体は、内因性のヒトタンパク質に対して高レベルの交差反応性抗体を産生することが判明しています(Vojdani et al.、2021年、詳細は後述)。ここでは部分的にしかレビューしていないが、スパイクタンパクに対する抗体が、以前のSARS-CoV-2感染またはワクチン接種によって誘発されるADEに寄与することを疑う十分な理由があり、それは急性または慢性の自己免疫および炎症状態として現れる可能性がある。ADEによる疾患の発現と、真の非ADEウイルス感染とを区別することは不可能であることを、我々は上述した。この観点から、mRNAワクチンを接種した直後に疾患や死亡が発生した場合、十分な調査を行っても、ワクチン反応が近因ではないと確定的に判断することはできないことを認識することが重要です。
病原性プライミングは、結果的にはADEと似ていますが、根本的なメカニズムが異なる概念です。2020年4月、SARS-CoV-2の長さに広がるスパイクタンパクやその他の抗原エピトープにさらされた後、自己反応性の抗体が生成される可能性に関する重要な論文が発表されました。Lyons-Weiler(2020)は、一般的に使われている「免疫強化」という言葉では、この症状の深刻さとその結果を捉えることができないと考え、「病原体の呼び水」という言葉を作った。Lyons-Weilerは、インシリコ解析において、SVMTriPデータベース(http://sysbio.unl.edu/SVMTriP/)に登録されているSARS-CoV-2タンパク質の抗原性エピトープをすべて比較し、それらのエピトープとヒトの内因性タンパク質との相同性をp-BLASTデータベース(https://blast.ncbi.nlm.nih.gov/Blast.cgi)で検索した。分析した37個のSARS-CoV-2タンパク質のうち、29個に抗原領域があった。この29個のうち1個を除くすべてのタンパク質が、ヒトタンパク質(推定自己抗原)と相同性を持ち、自己反応性を持つことが予測された。最も相同性が高かったのは、スパイク(S)タンパク質とNS3タンパク質で、どちらも6つの相同性を持つヒトタンパク質であった。ウイルスタンパク質と相同性を持つヒトの内因性タンパク質の機能解析を行ったところ、1/3以上のタンパク質が適応免疫系に関連していることがわかった。著者は、特に高齢者の重症化には、過去のウイルス曝露やワクチン接種により、これらの内在性タンパク質を標的とした抗体産生が開始されたことが関与しているのではないかと推測している。別のグループ(Ehrenfeldら、2020年)は、SARS-CoV-2の先行感染に関連して発見された幅広い自己免疫疾患についての論文の中で、スパイクタンパクがどのようにしてこのような一連の疾患を引き起こすかについても調査しています。彼らは、SARS-CoV-2によって生成されたスパイクタンパク質とオーバーラップするヒトのプロテオーム内のヘプタペプチドの文字列を同文献の表1に報告している。その結果、ヒトとスパイクタンパク質に含まれる26個のヘプタペプチドが確認された。興味深いことに、26個のオーバーラップするヘプタペプチドのうち2個は連続していることが判明し、ヒトの内在性タンパク質とスパイクタンパク質の間に共通して同一のペプチドが存在することが明らかになったのである。彼らは、発見されたオーバーラップするペプチドと、これが同時に多くの種類の自己免疫を引き起こす可能性について、「出現する臨床的シナリオは動揺させるものだ」とコメントしている。2020年5月には、VojdaniとKharrazianが、この点に関してもう1つの重要な論文を発表しました(2020年)。著者らは、2003年のSARSスパイクタンパク質に対するマウスとウサギのモノクローナル抗体を用いて、SARS-CoV-2のスパイクタンパク質だけでなく、いくつかの内因性ヒトタンパク質に対する反応性を調べた。その結果、SARS-CoV-2のスパイクタンパク質だけでなく、さまざまな内因性タンパク質に対しても高い結合性があることがわかった。"最も強い反応を示したのは、トランスグルタミナーゼ3(tTG3)、トランスグルタミナーゼ2(tTG2)、ENA、ミエリン塩基性タンパク質(MBP)、ミトコンドリア、核抗原(NA)、α-ミオシン、甲状腺ペルオキシダーゼ(TPO)、コラーゲン、クラウディン5+6、S100Bであった。(Vojdani and Kharrazian, 2020)。
これらの重要な知見は強調しておく必要がある。SARS-CoV-2スパイクなどのタンパク質に高い結合親和性を持つ抗体は、tTG(セリアック病に関連)、TPO(橋本甲状腺炎)、ミエリン塩基性タンパク質(多発性硬化症)、およびいくつかの内因性タンパク質にも高い結合親和性を持つ。Lyons-Weiler (2020)が予測し、上述したスパイクタンパク質によって生成される自己抗体は、最近発表されたin vitroの研究で確認された。Vojdaniら(2021)は、マウスやウサギのmAbではなく、SARS-CoV-2スパイクタンパク質に対するヒトのモノクローナル抗体(mAb)を使用して、抗体の交差反応性の問題を再度検討した。今回は、マウスやウサギのmAbではなく、SARS-CoV-2スパイクタンパク質に対するヒトのモノクローナル抗体を使用した。"0.32OD(光学密度)のカットオフ値で、SARS-CoV-2膜タンパク質抗体は、テストした55の抗原のうち18の抗原と反応した。" この18種類の内因性抗原は、肝臓、ミトコンドリア、神経系、消化器系、膵臓などの組織との反応を網羅している。Carterら(2020)は、小児の多系統炎症症候群(MIS-C)に関する報告の中で、23例を調査しました。(2020)は、23例を調査しました。23例中17例(68%)にSARS-CoV-2の先行感染の血清学的証拠がありました。患者集団で評価された3つの抗体(ヌクレオカプシド、RBD、スパイク)のうち、IgGスパイクタンパクの抗体光学密度(標準化された曲線に対する抗体濃度を定量化したもの(Wikipedia, 2021))が最も高かった(Carterら(2020)の図1d参照)。MIS-Cは現在、SARS-CoV-2や他のコロナウイルスへの事前暴露による免疫プライミングの一例であると一般的に推測されている。Buonsenso et.al. (2020)は、MIS-Cと過去のβ溶血性A群溶血性レンサ球菌感染症(GAS)に関連する疾患との間の複数の免疫学的類似性を検討した。著者らは、「COVID-19を持つ両親のもとで、子どもたちがSARS-CoV-2に何度もさらされることで、GAS感染時に起こるような免疫系のプライミングとして働き、遺伝的に素因のある子どもでは、[MIS-C]の発症につながるのではないかと推測できます。もう一つの仮説は、小児集団でははるかに頻繁に見られる他のコロナウイルスへの過去の感染が、SARS-CoV-2ウイルスに対する子どもの免疫系のプライミングになっているのではないかということです」2019年6月、GaleottiとBayry(2020)は、COVID-19患者における自己免疫疾患と炎症性疾患の両方の発生について検討しました。彼らはMIS-Cに焦点を当てて分析しています。COVID-19とMIS-Cの発症との間に時間的なつながりがあるという既報をいくつか検討し、両者の間に考えられるメカニズム上のつながりをいくつか述べた後、著者らは因果関係が確立されていないことを指摘した。この仮説を確認するためには、SARS-CoV-2のさまざまな抗原と自己抗原との相同性を、インシリコ的手法を用いて詳細に分析し、実験モデルで検証することを検討すべきである」と、やや予見的な提言をしている。まさに、冒頭のLyons-Weiler(2020)やEhrenfeld et. このセクションの冒頭で述べたLyons-Weiler(2020)やEhrenfeldら(2020)が行ったこの種のインシリコ解析こそが、ウイルス抗原と自己抗原の間に緊密な相同性を見出したのです。これは、GaleottiとBayryが仮説を立てた因果関係を決定的に確認するものではないかもしれませんが、強力な裏付けとなる証拠です。
自己免疫は、COVID-19 の後遺症としてより広く認識されるようになっています。これまで健康だった人が、特発性血小板減少性紫斑病、ギラン・バレ症候群、自己免疫性溶血性貧血などの疾患を発症したという報告が複数あります(Galeotti and Bayry, 2020)。COVID-19の症状後に皮膚症状を呈した全身性エリテマトーデス(SLE)の独立した症例報告が3件あります。1つは39歳の男性で、COVID-19の外来治療の2ヶ月後にSLEが発症しました(Zamani et.al.、2021年)。また、Slimaniら(2021)は、皮膚症状を伴う急速に進行した致死的なSLEの印象的な症例を記述している。自己抗体はCOVID-19患者に非常によく見られ、血液中に見られる抗体(Vlachoyiannopoulos et.al., 2020)や脳脊髄液(CFS)に見られる抗体(Franke et.al., 2021)などがあります。SARS-CoV-2は髄液中には存在しないが、SARS-CoV-2への曝露に反応して作られた自己抗体が、COVID-19患者に記録されている神経学的合併症の少なくとも一部を引き起こしているのではないかと推論されている。BertinらがArthritis & Rheumatology誌に投稿したLetter to the Editor(2020年)では、COVID-19患者の高い罹患率を指摘しています。Zuoら(2020)は、COVID-19の重症患者において、カルジオリピンに対する自己抗体が高い頻度で存在し、強い関連性(p=0.009)があることを指摘しています。(2020)は、入院中のCOVID-19患者の52%に抗リン脂質自己抗体を発見し、これらの抗体がこれらの患者における凝固異常の高い発生率に寄与していると推測しています。Schiaffino et al. (2020)は、入院中のCOVID-19患者の血清には、肝細胞や胃細胞の細胞膜に反応する自己抗体が高い割合で含まれていることを報告しました。また、ギラン・バレー症候群の患者1名の脳脊髄液(CFS)に抗体反応が認められたことから、著者らは、CFS中のタンパク質との交差反応が、一部のCOVID-19患者に見られる神経学的合併症を引き起こす可能性を示唆している。より最近のレビューでは、Gao et al. (2021)は、複数の研究において、COVID-19患者に高レベルの自己抗体が存在することを指摘している。彼らは、「大量のワクチンを投与することの潜在的な副作用のひとつとして、特に遺伝的に自己免疫の傾向がある個人において、自己免疫疾患が合併する可能性がある」と結論づけています。最近の論文では、広範囲の受容体や組織に対する自己抗体が、過去にSARS-CoV-2に感染したことのある人に見られるという、多くの証拠がまとめられています。"COVID-19の元患者31人全員が、受容体アゴニストとして作用する2〜7種類のGPCR-FAAB(Gタンパク質共役受容体機能自己抗体)を持っていた"(Wallukat et. 2021)標的受容体に対するアゴニスト活性とアンタゴニスト活性の両方を包含する、同定されたGPCR-FAABの多様性は、頻脈、徐脈、脱毛、注意欠陥、PoTS、神経障害など、COVID-19後の様々な症状と強く相関していました。 同研究では、上述のLyons-Weiler(2020)が予測した自己抗体に言及し、明らかに重大な懸念を示しています。「Sars-CoV-2スパイクタンパク質は、バイオミミクリーによって誘発される自己免疫プロセスの潜在的なエピトープ標的です[25]。したがって、GPCR-FAABがウイルスに対するワクチンによる免疫後にも検出可能になるかどうかを調査することは極めて重要になると感じています。"
SARS-CoV-2のスパイクタンパク質は、ヒトの複数の内因性タンパク質と広範な配列相同性を有しており、自己炎症性疾患や自己免疫疾患の発症に向けて免疫系を促進する可能性があるという証拠をここで検討した。このタンパク質は、膜融合による循環系からの排除を妨げる可能性のある2つの余分なプロリン残基で再設計されていることを考えると、これは特に問題である。これらの疾患は、MIS-Cのように急性かつ比較的短い期間で発症することもあれば、自然感染やワクチン接種などでスパイクタンパクにさらされた後、数か月から数年にわたって発症しない可能性もあります。COVID-19に陽性反応を示す人の中には、症状を示さない人も多く、PCR陽性の無症候性症例の数は、1.6%から56.5%と研究によって大きく異なります(Gao et al.、2020年)。COVID-19に鈍感な人は、おそらく非常に強い自然免疫系を持っています。健康な粘膜バリアの好中球とマクロファージは、ウイルスを速やかに排除し、多くの場合、適応システムによる抗体の産生を必要としません。しかし、このワクチンは、自然の粘膜バリアを越えて注射することと、RNAを含むナノ粒子として人工的に構成することで、粘膜免疫系を意図的に完全に回避している。Carsetti (2020)で述べられているように、自然免疫反応が強い人は、ほとんどの場合、無症状で感染するか、軽度のCOVID-19疾患を呈するだけである。しかし、そもそも必要のないワクチンに対して過剰な抗体が産生された結果、前述のように慢性的な自己免疫疾患に陥る可能性があります。
これらの重要な知見は強調しておく必要がある。SARS-CoV-2スパイクなどのタンパク質に高い結合親和性を持つ抗体は、tTG(セリアック病に関連)、TPO(橋本甲状腺炎)、ミエリン塩基性タンパク質(多発性硬化症)、およびいくつかの内因性タンパク質にも高い結合親和性を持つ。Lyons-Weiler (2020)が予測し、上述したスパイクタンパク質によって生成される自己抗体は、最近発表されたin vitroの研究で確認された。Vojdaniら(2021)は、マウスやウサギのmAbではなく、SARS-CoV-2スパイクタンパク質に対するヒトのモノクローナル抗体(mAb)を使用して、抗体の交差反応性の問題を再度検討した。今回は、マウスやウサギのmAbではなく、SARS-CoV-2スパイクタンパク質に対するヒトのモノクローナル抗体を使用した。"0.32OD(光学密度)のカットオフ値で、SARS-CoV-2膜タンパク質抗体は、テストした55の抗原のうち18の抗原と反応した。" この18種類の内因性抗原は、肝臓、ミトコンドリア、神経系、消化器系、膵臓などの組織との反応を網羅している。Carterら(2020)は、小児の多系統炎症症候群(MIS-C)に関する報告の中で、23例を調査しました。(2020)は、23例を調査しました。23例中17例(68%)にSARS-CoV-2の先行感染の血清学的証拠がありました。患者集団で評価された3つの抗体(ヌクレオカプシド、RBD、スパイク)のうち、IgGスパイクタンパクの抗体光学密度(標準化された曲線に対する抗体濃度を定量化したもの(Wikipedia, 2021))が最も高かった(Carterら(2020)の図1d参照)。MIS-Cは現在、SARS-CoV-2や他のコロナウイルスへの事前暴露による免疫プライミングの一例であると一般的に推測されている。Buonsenso et.al. (2020)は、MIS-Cと過去のβ溶血性A群溶血性レンサ球菌感染症(GAS)に関連する疾患との間の複数の免疫学的類似性を検討した。著者らは、「COVID-19を持つ両親のもとで、子どもたちがSARS-CoV-2に何度もさらされることで、GAS感染時に起こるような免疫系のプライミングとして働き、遺伝的に素因のある子どもでは、[MIS-C]の発症につながるのではないかと推測できます。もう一つの仮説は、小児集団でははるかに頻繁に見られる他のコロナウイルスへの過去の感染が、SARS-CoV-2ウイルスに対する子どもの免疫系のプライミングになっているのではないかということです」2019年6月、GaleottiとBayry(2020)は、COVID-19患者における自己免疫疾患と炎症性疾患の両方の発生について検討しました。彼らはMIS-Cに焦点を当てて分析しています。COVID-19とMIS-Cの発症との間に時間的なつながりがあるという既報をいくつか検討し、両者の間に考えられるメカニズム上のつながりをいくつか述べた後、著者らは因果関係が確立されていないことを指摘した。この仮説を確認するためには、SARS-CoV-2のさまざまな抗原と自己抗原との相同性を、インシリコ的手法を用いて詳細に分析し、実験モデルで検証することを検討すべきである」と、やや予見的な提言をしている。まさに、冒頭のLyons-Weiler(2020)やEhrenfeld et. このセクションの冒頭で述べたLyons-Weiler(2020)やEhrenfeldら(2020)が行ったこの種のインシリコ解析こそが、ウイルス抗原と自己抗原の間に緊密な相同性を見出したのです。これは、GaleottiとBayryが仮説を立てた因果関係を決定的に確認するものではないかもしれませんが、強力な裏付けとなる証拠です。
自己免疫は、COVID-19 の後遺症としてより広く認識されるようになっています。これまで健康だった人が、特発性血小板減少性紫斑病、ギラン・バレ症候群、自己免疫性溶血性貧血などの疾患を発症したという報告が複数あります(Galeotti and Bayry, 2020)。COVID-19の症状後に皮膚症状を呈した全身性エリテマトーデス(SLE)の独立した症例報告が3件あります。1つは39歳の男性で、COVID-19の外来治療の2ヶ月後にSLEが発症しました(Zamani et.al.、2021年)。また、Slimaniら(2021)は、皮膚症状を伴う急速に進行した致死的なSLEの印象的な症例を記述している。自己抗体はCOVID-19患者に非常によく見られ、血液中に見られる抗体(Vlachoyiannopoulos et.al., 2020)や脳脊髄液(CFS)に見られる抗体(Franke et.al., 2021)などがあります。SARS-CoV-2は髄液中には存在しないが、SARS-CoV-2への曝露に反応して作られた自己抗体が、COVID-19患者に記録されている神経学的合併症の少なくとも一部を引き起こしているのではないかと推論されている。BertinらがArthritis & Rheumatology誌に投稿したLetter to the Editor(2020年)では、COVID-19患者の高い罹患率を指摘しています。Zuoら(2020)は、COVID-19の重症患者において、カルジオリピンに対する自己抗体が高い頻度で存在し、強い関連性(p=0.009)があることを指摘しています。(2020)は、入院中のCOVID-19患者の52%に抗リン脂質自己抗体を発見し、これらの抗体がこれらの患者における凝固異常の高い発生率に寄与していると推測しています。Schiaffino et al. (2020)は、入院中のCOVID-19患者の血清には、肝細胞や胃細胞の細胞膜に反応する自己抗体が高い割合で含まれていることを報告しました。また、ギラン・バレー症候群の患者1名の脳脊髄液(CFS)に抗体反応が認められたことから、著者らは、CFS中のタンパク質との交差反応が、一部のCOVID-19患者に見られる神経学的合併症を引き起こす可能性を示唆している。より最近のレビューでは、Gao et al. (2021)は、複数の研究において、COVID-19患者に高レベルの自己抗体が存在することを指摘している。彼らは、「大量のワクチンを投与することの潜在的な副作用のひとつとして、特に遺伝的に自己免疫の傾向がある個人において、自己免疫疾患が合併する可能性がある」と結論づけています。最近の論文では、広範囲の受容体や組織に対する自己抗体が、過去にSARS-CoV-2に感染したことのある人に見られるという、多くの証拠がまとめられています。"COVID-19の元患者31人全員が、受容体アゴニストとして作用する2〜7種類のGPCR-FAAB(Gタンパク質共役受容体機能自己抗体)を持っていた"(Wallukat et. 2021)標的受容体に対するアゴニスト活性とアンタゴニスト活性の両方を包含する、同定されたGPCR-FAABの多様性は、頻脈、徐脈、脱毛、注意欠陥、PoTS、神経障害など、COVID-19後の様々な症状と強く相関していました。 同研究では、上述のLyons-Weiler(2020)が予測した自己抗体に言及し、明らかに重大な懸念を示しています。「Sars-CoV-2スパイクタンパク質は、バイオミミクリーによって誘発される自己免疫プロセスの潜在的なエピトープ標的です[25]。したがって、GPCR-FAABがウイルスに対するワクチンによる免疫後にも検出可能になるかどうかを調査することは極めて重要になると感じています。"
SARS-CoV-2のスパイクタンパク質は、ヒトの複数の内因性タンパク質と広範な配列相同性を有しており、自己炎症性疾患や自己免疫疾患の発症に向けて免疫系を促進する可能性があるという証拠をここで検討した。このタンパク質は、膜融合による循環系からの排除を妨げる可能性のある2つの余分なプロリン残基で再設計されていることを考えると、これは特に問題である。これらの疾患は、MIS-Cのように急性かつ比較的短い期間で発症することもあれば、自然感染やワクチン接種などでスパイクタンパクにさらされた後、数か月から数年にわたって発症しない可能性もあります。COVID-19に陽性反応を示す人の中には、症状を示さない人も多く、PCR陽性の無症候性症例の数は、1.6%から56.5%と研究によって大きく異なります(Gao et al.、2020年)。COVID-19に鈍感な人は、おそらく非常に強い自然免疫系を持っています。健康な粘膜バリアの好中球とマクロファージは、ウイルスを速やかに排除し、多くの場合、適応システムによる抗体の産生を必要としません。しかし、このワクチンは、自然の粘膜バリアを越えて注射することと、RNAを含むナノ粒子として人工的に構成することで、粘膜免疫系を意図的に完全に回避している。Carsetti (2020)で述べられているように、自然免疫反応が強い人は、ほとんどの場合、無症状で感染するか、軽度のCOVID-19疾患を呈するだけである。しかし、そもそも必要のないワクチンに対して過剰な抗体が産生された結果、前述のように慢性的な自己免疫疾患に陥る可能性があります。
マイアミビーチで産科医をしていたグレゴリー・マイケル医師は、ファイザー社/バイオンテック社のCOVID-19ワクチンの初回投与を受けた16日後に脳出血で死亡しました。ワクチン接種後3日以内に、免疫細胞が血小板を攻撃して破壊する自己免疫疾患である特発性血小板減少性紫斑病(ITP)を発症しました。血小板の数が急激に減少したため、内出血が止まらなくなり、脳梗塞を発症したことは、ニューヨーク・タイムズ紙の記事でも紹介されています(Grady and Mazzei, 2021)。ニューヨーク・タイムズ紙はその後、SARS-CoV-2ワクチン接種後のITPの他の数例を取り上げた2つ目の記事を掲載し(Grady, 2021)、SARS-CoV-2ワクチン接種後の血小板数の急激な減少と血小板減少の他の数例がVaccine Adverse Event Reporting System(VAERS)で報告されています。
mRNAベースのワクチンに関するいくつかの研究では、脾臓が免疫反応の主要な活動拠点であることが独自に確認されています。mRNAベースのインフルエンザウイルスワクチンに関する研究は、ワクチンに含まれるmRNAの生体内分布に関する疑問に答える上で極めて重要である。このワクチンは、SARS-CoV-2ワクチンと同様に、ヘマグルチニン(コロナウイルスのスパイクタンパク質に相当する表面融合タンパク質)をコードする修飾RNAを含む脂質ナノ粒子として設計され、筋肉注射で投与された。様々な組織サンプルを用いてmRNAの濃度を経時的に追跡し、各部位で観察された最大濃度を記録した。驚くことではないが、濃度は注射部位の筋肉で最も高かった(5,680ng/mL)。この濃度は時間の経過とともに徐々に低下し、注射後18.8時間で元の値の半分になった。次に高かったのは近位リンパ節で、ピーク時には2,120ng/mL、半分になったのは25.4時間後であった。臓器では、脾臓(86.69ng/mL)と肝臓(47.2ng/mL)で圧倒的に高い値を示した。体内の他の場所では、100倍から1,000倍も低い濃度でした。特に遠位リンパ節では、ピーク時の濃度が8ng/mLにとどまっていた。研究チームは、mRNAは注射部位からリンパ系を経由して肝臓や脾臓に分布し、最終的には全身に行き渡ると結論づけた。これは、マクロファージをはじめとする免疫細胞内で輸送されたmRNAが、免疫細胞に取り込まれることによって起こると考えられます。
International Journal of Vaccine Theory, Practice, and Research2(1), May 10, 2021 Page|419 筋肉注射部位に取り込まれます。不快なことに、はるかに低いレベルではあるものの、脳内にも到達します(Bahl et al. Modernaワクチンの欧州医薬品庁の評価報告書でも、筋肉内投与後の脳内では、血漿中で検出されるレベルの約2%でmRNAが検出される可能性があることが指摘されている(欧州医薬品庁、2021年)。RNAワクチンの生体内分布経路を追跡するために行われた別の実験では、狂犬病のRNAワクチンをラットに筋肉内に単回投与した。このワクチンには、免疫原性のある狂犬病タンパク質のコードとRNAポリメラーゼのコードが含まれており、水中油型のナノエマルジョンとして製剤化されていた。したがって、このワクチンはSARS-CoV-2 mRNAワクチンを完全に代表するものではない。しかし、筋肉内投与であることや、免疫細胞によるRNAの取り込みに依存していることから、SARS-CoV-2ワクチンと同様の経路で組織内を移動すると考えられる。著者らは、排液リンパ節の拡大を観察し、組織研究により、狂犬病RNAが1日以内に注射部位と排液リンパ節に最初に現れ、血液、肺、脾臓、肝臓にも見られたことを明らかにした(Stokesら、2020年)。最後に、ワクチン接種の代替アプローチとして、ルシフェラーゼを発現するmRNAナノ粒子とルシフェラーゼを発現するmRNA樹状細胞を比較した研究では、ルシフェラーゼシグナルは、ナノ粒子の送達メカニズムにより、より広範囲のリンパ系部位に到達することが明らかになった。さらに重要なことに、ルシフェラーゼシグナルは、樹状細胞では肺に集中していたのに対し、ナノ粒子では脾臓に集中していた(Firdessa-Fite and Creuso, 2020)。
International Journal of Vaccine Theory, Practice, and Research2(1), May 10, 2021 Page|419 筋肉注射部位に取り込まれます。不快なことに、はるかに低いレベルではあるものの、脳内にも到達します(Bahl et al. Modernaワクチンの欧州医薬品庁の評価報告書でも、筋肉内投与後の脳内では、血漿中で検出されるレベルの約2%でmRNAが検出される可能性があることが指摘されている(欧州医薬品庁、2021年)。RNAワクチンの生体内分布経路を追跡するために行われた別の実験では、狂犬病のRNAワクチンをラットに筋肉内に単回投与した。このワクチンには、免疫原性のある狂犬病タンパク質のコードとRNAポリメラーゼのコードが含まれており、水中油型のナノエマルジョンとして製剤化されていた。したがって、このワクチンはSARS-CoV-2 mRNAワクチンを完全に代表するものではない。しかし、筋肉内投与であることや、免疫細胞によるRNAの取り込みに依存していることから、SARS-CoV-2ワクチンと同様の経路で組織内を移動すると考えられる。著者らは、排液リンパ節の拡大を観察し、組織研究により、狂犬病RNAが1日以内に注射部位と排液リンパ節に最初に現れ、血液、肺、脾臓、肝臓にも見られたことを明らかにした(Stokesら、2020年)。最後に、ワクチン接種の代替アプローチとして、ルシフェラーゼを発現するmRNAナノ粒子とルシフェラーゼを発現するmRNA樹状細胞を比較した研究では、ルシフェラーゼシグナルは、ナノ粒子の送達メカニズムにより、より広範囲のリンパ系部位に到達することが明らかになった。さらに重要なことに、ルシフェラーゼシグナルは、樹状細胞では肺に集中していたのに対し、ナノ粒子では脾臓に集中していた(Firdessa-Fite and Creuso, 2020)。
免疫性血小板減少症(ITP)は、COVID-19の重要な合併症として登場しました(Bhattacharjee and Banerjee, 2020)。多くの場合、ITPは病気が完全に回復した後、つまりウイルスが除去された後に出現することから、自己免疫現象であることが示唆されています。ワクチン接種後にITPが発生する経路として考えられるのは、mRNAナノ粒子を積んだ免疫細胞がリンパ系を経由して脾臓に移動することである。これらの免疫細胞は、ナノ粒子に含まれるコードに従ってスパイクタンパクを産生し、スパイクタンパクがB細胞によるIgG抗体の産生を誘発すると考えられる。ITPは、最初に皮膚上の点状出血や紫斑、および/または粘膜表面からの出血として現れる。ITPは、出血や脳卒中による致死率の高い疾患です。ITPは、血小板破壊の亢進と血小板産生の低下の両方を特徴とし、自己抗体が極めて重要な役割を果たしている(Sun and Shan, 2019)。血小板は抗血小板抗体と免疫複合体によってコーティングされ、これによって食細胞によるクリアランスが誘導される。特にオートファジーが損なわれている条件下では、結果として生じるシグナルカスケードは、血小板産生の前駆細胞である骨髄中の巨核球の産生抑制にもつながります(Sun and Shan, 2019)。COVID-19と診断された患者の事例は、COVID-19核酸検査が陰性であったことに基づいて退院した数日後に、突然の血小板減少症を発症したことから明らかになりました。この発症後、血小板を産生する巨核球の数が減少していることが確認され、一方で自己免疫抗体は陰性であったことから、血小板の破壊ではなく、血小板の産生に問題があることが示唆されました(Chenら、2020年)。
International Journal of Vaccine Theory, Practice, and Research2(1), May 10, 2021 Page|420オートファジーは、損傷したタンパク質、小器官、および細菌やウイルスの病原体を除去するために不可欠である。オートファジー経路の変化は、インフルエンザウイルス、MERS-CoV、SARS-CoV、そして重要なことにSARS-CoV-2を含む多くの呼吸器系ウイルスの病因の特徴として現れている(Limanaqi et al.、2020)。オートファジーは、mRNAワクチンによってプログラムされた免疫細胞が産生するスパイクタンパクのクリアランスに重要であることは間違いない。オートファジーが損なわれると、マクロファージがワクチンのmRNAから産生するスパイクタンパクのクリアランスが妨げられると推測できます。後述するように、血小板は自食作用のあるタンパク質を持っており、オートファジーを利用してウイルスを除去しています。オートファジーの障害はITPの特徴であり、血小板に対する自己免疫攻撃の鍵を握っている可能性があります(Wang et al.2019)。
International Journal of Vaccine Theory, Practice, and Research2(1), May 10, 2021 Page|420オートファジーは、損傷したタンパク質、小器官、および細菌やウイルスの病原体を除去するために不可欠である。オートファジー経路の変化は、インフルエンザウイルス、MERS-CoV、SARS-CoV、そして重要なことにSARS-CoV-2を含む多くの呼吸器系ウイルスの病因の特徴として現れている(Limanaqi et al.、2020)。オートファジーは、mRNAワクチンによってプログラムされた免疫細胞が産生するスパイクタンパクのクリアランスに重要であることは間違いない。オートファジーが損なわれると、マクロファージがワクチンのmRNAから産生するスパイクタンパクのクリアランスが妨げられると推測できます。後述するように、血小板は自食作用のあるタンパク質を持っており、オートファジーを利用してウイルスを除去しています。オートファジーの障害はITPの特徴であり、血小板に対する自己免疫攻撃の鍵を握っている可能性があります(Wang et al.2019)。
脾臓はヒトで最大の二次リンパ器官であり、体内の血小板供給の1/3もの量が含まれています。脾臓は、血小板に対する抗体反応を制御することから、ITPにおける血小板破壊の主要な部位となります。ITPに関連する2つの主な自己抗体は、免疫グロブリンG(IgG)と血小板上の糖タンパク質(GP)IIb/IIIa複合体に対するものです(Aslam et al. スパイクタンパク質などの抗原にさらされると、脾臓の辺縁部に存在する好中球がB細胞と相互作用する能力を獲得し、抗体の産生を誘導します(Puga et al. これは、ワクチン接種を成功させるために非常に重要であると考えられる。mRNAのプソイドウリジン修飾は、RNAが脾臓に到達するのに十分な時間、生き残ることを保証するために重要である。mRNAナノ粒子をマウスに注入した実験では、注入後1、4、24時間後の脾臓において、送達されたmRNAとコード化されたタンパク質の両方が、修飾されていないRNAを使用した場合よりも有意に高いレベルで検出された(Karikó et al., 2008)。 脾臓における洗練された血小板-好中球のクロスコミュニケーションメカニズムは、NETosisと呼ばれる病理学的反応を介して、血小板減少症を引き起こす可能性がある。血小板-TLR7(toll-like receptor 7)は、循環中のインフルエンザ粒子を認識し、血小板によるウイルスの取り込みとエンドサイトーシスを引き起こす。ウイルスを飲み込んだ後、血小板は好中球を刺激して、好中球細胞外トラップ(NET)内にDNAを放出させ(Koupenova et al.2019)、過剰に放出されたDNAは血栓促進カスケードを引き起こす。
インフルエンザウイルスは、コロナウイルスと同様に、一本鎖のRNAウイルスです。血小板減少症は、インフルエンザ感染症の一般的な合併症であり、その重症度は重症患者の臨床転帰を予測する(Jansen et al. 血小板は、その膜に豊富な糖タンパク質を含んでおり、これらは受容体として機能し、内皮壁への接着をサポートします。血小板の糖タンパク質に対する自己抗体は、自己免疫性血小板減少症の患者の大部分に見られます(Lipp et al., 1998)。インフルエンザウイルスは、糖タンパク質を介して細胞に結合し、ノイラミニダーゼという酵素を放出して、糖タンパク質に結合しているグリコサミノグリカンを分解して遊離させることができます。この作用により、血小板の糖タンパク質がB細胞にさらされ、自己抗体の産生が誘発されると考えられる。病原体Streptococcus pneumoniaeが発現するノイラミニダーゼは、血小板を脱離させ、血小板の過活動を引き起こすことが示されている(Kullaya et al.
血小板は、ウイルスのクリアランスに重要な役割を果たしているようです。血小板をインフルエンザウイルスと一緒にインキュベートしてから1分以内に、ウイルスはすでに血小板に付着していた。その後の内在化(おそらく食作用による)は、30分後にピークを迎えた(Jansenら、2020年)。SARS-CoV-2スパイクタンパク質は、シアル酸を結合するので、血小板膜の糖タンパク質に付着する可能性がある(Bakerら、2020年)。SARS CoVのスパイクタンパク質S1とインフルエンザウイルスが発現するノイラミニダーゼとの間には構造的な類似性があり、スパイクタンパク質がノイラミニダーゼ活性を有することを意味しているのかもしれない(Zhang et al.、2004)。いくつかのウイルスがノイラミニダーゼを発現しており、一般的にノイラミニダーゼは酵素的に糖タンパク質の糖鎖を脱シアル化して異化する作用を持っています。したがって、生きたウイルスが存在しなくても、特にオートファジーが損なわれている状況では、mRNAワクチン接種後にITPにつながる危険なカスケードが発生する可能性があると考えられます。腕の筋肉に存在する免疫細胞は、RNA粒子を取り込み、リンパ系内を循環して脾臓に蓄積します。脾臓では、免疫細胞がスパイクタンパクを大量に産生し、血小板の糖タンパクに結合して脱シアル化する。血小板が好中球と相互作用すると、NETosisが起こり、炎症カスケードが開始される。露出した糖タンパク質は自己免疫抗体の標的となり、血小板を攻撃して除去するため、血小板数が急激に減少し、生命を脅かす事態に陥る。
血小板は、ウイルスのクリアランスに重要な役割を果たしているようです。血小板をインフルエンザウイルスと一緒にインキュベートしてから1分以内に、ウイルスはすでに血小板に付着していた。その後の内在化(おそらく食作用による)は、30分後にピークを迎えた(Jansenら、2020年)。SARS-CoV-2スパイクタンパク質は、シアル酸を結合するので、血小板膜の糖タンパク質に付着する可能性がある(Bakerら、2020年)。SARS CoVのスパイクタンパク質S1とインフルエンザウイルスが発現するノイラミニダーゼとの間には構造的な類似性があり、スパイクタンパク質がノイラミニダーゼ活性を有することを意味しているのかもしれない(Zhang et al.、2004)。いくつかのウイルスがノイラミニダーゼを発現しており、一般的にノイラミニダーゼは酵素的に糖タンパク質の糖鎖を脱シアル化して異化する作用を持っています。したがって、生きたウイルスが存在しなくても、特にオートファジーが損なわれている状況では、mRNAワクチン接種後にITPにつながる危険なカスケードが発生する可能性があると考えられます。腕の筋肉に存在する免疫細胞は、RNA粒子を取り込み、リンパ系内を循環して脾臓に蓄積します。脾臓では、免疫細胞がスパイクタンパクを大量に産生し、血小板の糖タンパクに結合して脱シアル化する。血小板が好中球と相互作用すると、NETosisが起こり、炎症カスケードが開始される。露出した糖タンパク質は自己免疫抗体の標的となり、血小板を攻撃して除去するため、血小板数が急激に減少し、生命を脅かす事態に陥る。
イスラエルのハイファにあるTel Aviv Medical CenterとCarmel Medical Centerで行われた観察研究では、ファイザー社のワクチン接種後に帯状疱疹の発生率が有意に増加したことが明らかになりました(Furer 2021)。この観察研究では、自己免疫性炎症性リウマチ疾患(AIIRD)の既往がある患者をモニタリングしました。研究期間中の491人のAIIRD患者のうち、6人(1.2%)が1回目または2回目のワクチン接種後2日から2週間の間に初発で帯状疱疹と診断されました。CDCのVAERSデータベース(2021年4月19日に照会)には、ModernaまたはPfizerのいずれかのワクチン接種後に帯状疱疹の報告が278件ありました。2021年4月19日にCDCのVAERSデータベースに照会したところ、ModernaまたはPfizerのワクチン接種後の帯状疱疹の報告が278件ありました。VAERSへの過少報告(Lazarus et al. しかし、帯状疱疹の発生は、VAERSにおけるもう一つの重要な「シグナル」であると考えています。この帯状疱疹に対するリスクの増加が有効であれば、より広い範囲で重要な意味を持つ可能性があります。複数の研究により、原発性または後天性の免疫不全を持つ患者は、重篤な帯状疱疹感染症にかかりやすいことが示されています(Ansari et al., 2020)。このことは、mRNAワクチンが自然免疫反応を抑制している可能性を示唆しています。自己免疫疾患ではTNF-αとI型インターフェロンの間にクロストークがあり、それぞれが他方を抑制しています(Palucka et al. I型インターフェロンは、水痘・帯状疱疹ウイルスの複製を抑制する(Ku et al.、2016)。TNF-αは、ワクチンに含まれる脂質ナノ粒子によって誘導される炎症反応で急激にアップレギュレートされます。そのアップレギュレーションは、関節リウマチの慢性的な炎症状態にも関連している(Matsuno et al. ワクチン接種後のTNF-αの過剰な発現は、潜在的な帯状疱疹を抑える樹状細胞のINF-α反応を妨害しているのかもしれません。
SARS-CoV-2は、脳血管を含む多臓器の血管系に深刻な影響を及ぼすという構図が見えてきた。先に述べたように、スパイクタンパク質は、細胞膜のACE2と結合することで、ウイルスの宿主細胞への侵入を促進する。ACE2はI型の内在性膜タンパク質で、アンジオテンシンIIをアンジオテンシン(1-7)に切断することで、アンジオテンシンIIを消去し、血圧を下げる働きがある。一連の論文の中で、Yuichiro Suzukiは他の著者と共同で、スパイクタンパク質がそれ自体で、潜在的に広範な結果を伴う血管系でのシグナル伝達反応を引き起こすことができるという強い議論を提示した(Suzuki, 2020; Suzuki et al., 2020; Suzuki et al., 2021; Suzuki and Gychka, 2021)。これらの著者は、COVID-19の重症例では、SARS-CoV-2が肺血管系に著しい形態変化を引き起こすことを観察した。COVID-19で死亡した患者の肺を死後分析したところ、主に中膜の肥大による血管壁の肥厚が組織学的に認められました。肥大した平滑筋細胞は丸みを帯び、膨らんだ核と細胞質の空胞を伴っていた(Suzuki et al.、2020)。さらに彼らは、培養したヒト肺動脈平滑筋細胞にSARS-CoV-2のスパイクタンパク質S1サブユニットを作用させると、他のウイルス成分がなくても細胞シグナルを促進するのに十分であることを示した。
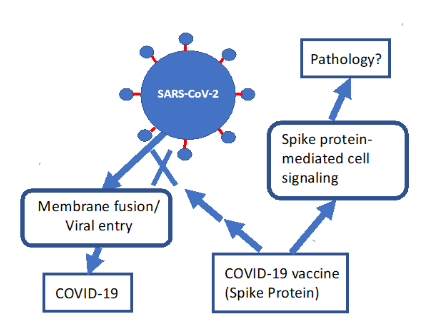
続いて発表された論文(Suzukiら、2021年、Suzuki and Gychka、2021年)では、スパイクタンパク質S1サブユニットがACE2を抑制し、死亡率の非常に高い重症肺疾患である肺動脈性肺高血圧症(PAH)に似た状態を引き起こすことを示した。彼らのモデルは、ここでは図2に描かれています。不吉なことに、SuzukiとGychka(2021)は次のように書いている。"このように、これらのin vivo研究は、SARS-CoV-1のスパイクタンパク質(他のウイルスを含まない)がACE2の発現を低下させ、アンギオテンシンIIのレベルを上昇させ、肺傷害を悪化させることを実証した。" ここで彼らが参照した「in vivo研究」(Kubaら、2005年)では、SARSコロナウイルスによる肺傷害は、主にSARS-CoVスパイクタンパク質によるACE2の阻害により、アンジオテンシンIIが大きく増加することが示されていました。さらにSuzukiら(2021)は、130pMという低濃度のSARS-CoV-2ウイルスのS1成分がMEK/ERK/MAPKシグナル経路を活性化し、細胞の成長を促進することを実験的に示した。彼らは、このような作用は肺血管系に限定されるものではないだろうと推測した。心臓の血管系で引き起こされたシグナルカスケードは、冠動脈疾患の原因となり、脳での活性化は脳卒中の原因となる。また、全身性の高血圧も予測される。研究チームは、スパイクタンパクが肺動脈性肺高血圧を促進することで、SARS-CoV-2から回復した患者が後に右心室性心不全を発症する可能性があると考えた。さらに、mRNAワクチンに反応して同様の効果が起こる可能性を示唆し、スパイクタンパクに基づくCOVID-19ワクチンを接種した小児と成人の両方に長期的な影響が及ぶ可能性を警告しています(Suzuki and Gychka, 2021)。
Leiら(2021年)の興味深い研究によると、SARS-CoV-2のS1タンパク質で装飾され、そのコアにウイルスDNAを含まない擬似ウイルス球体が、動脈の両方で炎症と損傷を引き起こすことがわかった。2021年)は、SARS-CoV-2のS1タンパク質で装飾され、ウイルスのDNAが含まれていないシュードウイルスの球体が、気管内にさらされたマウスの動脈と肺の両方に炎症と損傷を引き起こすことを発見した。続いて、健康なヒトの内皮細胞にも同様の偽ウイルス粒子を照射した。この粒子が内皮細胞のACE2受容体に結合すると、内皮細胞ではミトコンドリアの損傷と断片化が起こり、関連する組織に特徴的な病理学的変化が見られたという。この研究により、COVID-19による内皮障害を引き起こすには、ウイルスゲノムの残りの部分と結合していないスパイクタンパクだけで十分であることが明らかになった。COVID-19に関連した頭痛、吐き気、めまいなどの神経学的症状、脳炎、致命的な脳血栓などはすべて、脳に対するウイルスの損傷作用を示す指標である。Buzhdyganら(2020)は、ヒト初代脳微小血管内皮細胞がこれらの症状を引き起こす可能性を提案しました。ACE2は、脳毛細血管の内皮細胞にユビキタスに発現している。ACE2の発現は、COVID-19による悪い結果のリスクファクターである認知症と高血圧に関連して、脳血管系でアップレギュレートされる。血液脳関門のin vitro研究では、スパイクタンパクのS1成分が関門の完全性の喪失を促進した。このことは、スパイクタンパクが単独で作用すると、脳内皮細胞の炎症促進反応を誘発し、この病気の神経学的結果を説明できることを示唆している(Buzhdygan et al., 2020)。mRNAワクチンはスパイクタンパク質の合成を誘導し、理論的には同様の作用で脳に害を及ぼす可能性があるため、この観察結果の意味合いは気になるところです。また、ACE2受容体が精巣のライディッヒ細胞に高発現していることから、ワクチンによって内因性に生成されたスパイクタンパクは、男性の精巣にも悪影響を及ぼす可能性があります(Verma et al.、2020年)。現在、複数の研究により、コロナウイルスのスパイクタンパク質がACE2受容体を介して精巣の細胞にアクセスし、男性の生殖を阻害することが明らかになっています(Navarraら、2020年、Wang and Xu、2020年)。COVID-19の男性患者6人の精巣を死後検査した論文では、精巣が損傷した患者の精巣の間質細胞にスパイクタンパクが存在することが顕微鏡で確認されました(Achuaら、2021年)。

続いて発表された論文(Suzukiら、2021年、Suzuki and Gychka、2021年)では、スパイクタンパク質S1サブユニットがACE2を抑制し、死亡率の非常に高い重症肺疾患である肺動脈性肺高血圧症(PAH)に似た状態を引き起こすことを示した。彼らのモデルは、ここでは図2に描かれています。不吉なことに、SuzukiとGychka(2021)は次のように書いている。"このように、これらのin vivo研究は、SARS-CoV-1のスパイクタンパク質(他のウイルスを含まない)がACE2の発現を低下させ、アンギオテンシンIIのレベルを上昇させ、肺傷害を悪化させることを実証した。" ここで彼らが参照した「in vivo研究」(Kubaら、2005年)では、SARSコロナウイルスによる肺傷害は、主にSARS-CoVスパイクタンパク質によるACE2の阻害により、アンジオテンシンIIが大きく増加することが示されていました。さらにSuzukiら(2021)は、130pMという低濃度のSARS-CoV-2ウイルスのS1成分がMEK/ERK/MAPKシグナル経路を活性化し、細胞の成長を促進することを実験的に示した。彼らは、このような作用は肺血管系に限定されるものではないだろうと推測した。心臓の血管系で引き起こされたシグナルカスケードは、冠動脈疾患の原因となり、脳での活性化は脳卒中の原因となる。また、全身性の高血圧も予測される。研究チームは、スパイクタンパクが肺動脈性肺高血圧を促進することで、SARS-CoV-2から回復した患者が後に右心室性心不全を発症する可能性があると考えた。さらに、mRNAワクチンに反応して同様の効果が起こる可能性を示唆し、スパイクタンパクに基づくCOVID-19ワクチンを接種した小児と成人の両方に長期的な影響が及ぶ可能性を警告しています(Suzuki and Gychka, 2021)。
Leiら(2021年)の興味深い研究によると、SARS-CoV-2のS1タンパク質で装飾され、そのコアにウイルスDNAを含まない擬似ウイルス球体が、動脈の両方で炎症と損傷を引き起こすことがわかった。2021年)は、SARS-CoV-2のS1タンパク質で装飾され、ウイルスのDNAが含まれていないシュードウイルスの球体が、気管内にさらされたマウスの動脈と肺の両方に炎症と損傷を引き起こすことを発見した。続いて、健康なヒトの内皮細胞にも同様の偽ウイルス粒子を照射した。この粒子が内皮細胞のACE2受容体に結合すると、内皮細胞ではミトコンドリアの損傷と断片化が起こり、関連する組織に特徴的な病理学的変化が見られたという。この研究により、COVID-19による内皮障害を引き起こすには、ウイルスゲノムの残りの部分と結合していないスパイクタンパクだけで十分であることが明らかになった。COVID-19に関連した頭痛、吐き気、めまいなどの神経学的症状、脳炎、致命的な脳血栓などはすべて、脳に対するウイルスの損傷作用を示す指標である。Buzhdyganら(2020)は、ヒト初代脳微小血管内皮細胞がこれらの症状を引き起こす可能性を提案しました。ACE2は、脳毛細血管の内皮細胞にユビキタスに発現している。ACE2の発現は、COVID-19による悪い結果のリスクファクターである認知症と高血圧に関連して、脳血管系でアップレギュレートされる。血液脳関門のin vitro研究では、スパイクタンパクのS1成分が関門の完全性の喪失を促進した。このことは、スパイクタンパクが単独で作用すると、脳内皮細胞の炎症促進反応を誘発し、この病気の神経学的結果を説明できることを示唆している(Buzhdygan et al., 2020)。mRNAワクチンはスパイクタンパク質の合成を誘導し、理論的には同様の作用で脳に害を及ぼす可能性があるため、この観察結果の意味合いは気になるところです。また、ACE2受容体が精巣のライディッヒ細胞に高発現していることから、ワクチンによって内因性に生成されたスパイクタンパクは、男性の精巣にも悪影響を及ぼす可能性があります(Verma et al.、2020年)。現在、複数の研究により、コロナウイルスのスパイクタンパク質がACE2受容体を介して精巣の細胞にアクセスし、男性の生殖を阻害することが明らかになっています(Navarraら、2020年、Wang and Xu、2020年)。COVID-19の男性患者6人の精巣を死後検査した論文では、精巣が損傷した患者の精巣の間質細胞にスパイクタンパクが存在することが顕微鏡で確認されました(Achuaら、2021年)。
プリオン病とは、生体内の重要なタンパク質が誤って折り畳まれ、毒性のあるオリゴマーを形成し、最終的にはフィブリルとして析出して神経細胞に広範な損傷を与えることによって引き起こされる神経変性疾患の総称である。Stanley Prusinerは、これらのミスフォールドしたタンパク質を表現するために「プリオン」という名前を最初に作りました(Prusiner, 1982)。最もよく知られているプリオン病は、1980年代にヨーロッパの牛で流行したMADCOW病(牛海綿状脳症)です。プリオン病に関するCDCのWebサイトには、「プリオン病は通常、急速に進行し、常に致命的である」と記載されています(Centers for Disease Control and Prevention, 2018)。 現在、アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症(ALS)など、多くの神経変性疾患がプリオン病である可能性があると考えられており、研究者たちは、これらの疾患に関連する特定のタンパク質性感染粒子を特定している(Weickenmeierら、2019年)。さらに、研究者たちは、グリシンジッパーモチーフと呼ばれる、毒性のあるオリゴマーにミスフォールドしやすいことに関連する特徴的なモチーフを特定している。これは、GxxxGと表される、2つのグリシン残基が3つのアミノ酸を介在させたパターンで特徴づけられる。 MADCOWに関連するウシのプリオンには、10個のGxxxGが並んだ壮大な配列がある(uniprot.org/uniprot/P10279参照)。より一般的には、GxxxGモチーフは膜貫通タンパク質に共通する特徴であり、グリシンはタンパク質のα-ヘリックスを架橋するのに不可欠な役割を果たしている(Mueller et al.2014)。プリオンタンパク質は、α-へリックスがβ-シートとしてミスフォールドすると毒性を発揮し、タンパク質が膜に入る能力が損なわれる(Prusiner, 1982)。アミロイドβ前駆体タンパク質(APP)のグリシンジッパー膜貫通モチーフ内のグリシンは、アルツハイマー病に関連するアミロイドβのミスフォールドに中心的な役割を果たしている(Decock et al.、2016)。APPには、合計4つのGxxxGモチーフが含まれている。SARS-CoV-2スパイクタンパク質が膜貫通タンパク質であり、その配列に5つのGxxxGモチーフが含まれていることを考えると(uniprot.org/uniprot/P0DTC2参照)、プリオンとして振る舞うことが極めて妥当であることがわかる。GxxxG配列の1つは、膜融合ドメイン内に存在する。mRNAワクチンは、融合ドメインの隣り合う2つのアミノ酸を1対のプロリンに置き換えた改変された配列で設計されていることを思い出してほしい。これは、タンパク質をオープン状態にして、膜との融合を困難にするために意図的に行われたものです。J.Bart Classen(2021年)の論文では、mRNAワクチンに含まれるスパイクタンパク質がプリオン様の病気を引き起こす可能性があると提唱していますが、これはスパイクタンパク質が多くの既知のタンパク質と結合し、それらのタンパク質をプリオンになるようにミスフォールドさせる能力を持っていることが一因です。IdreesとKumar(2021)は、スパイクタンパク質のS1成分が機能的なアミロイドとして働き、毒性のある凝集体を形成する傾向があると提案している。Tetz and Tetz(2020)によると、SARS-CoV-2のスパイクタンパク質には、他のコロナウイルスのスパイクタンパク質には存在しないプリオン領域が存在するという。これは査読なしの論文で報告されたものですが、著者らは2018年に複数の真核生物ウイルスにプリオン様領域を同定した論文を発表しており、この分野でかなりの専門知識を有しています(Tetz and Tetz, 2018)。ここでの最後のポイントは、特にファイザーのワクチンに関する情報に関連します。欧州医薬品庁(EMA)の公開評価報告書は、欧州でワクチンを販売するための承認を得るために提出された文書です。この報告書には、製造工程のレビューや、関連する様々な試験データが詳細に記載されています。その中で気になるのが、注射液に含まれるRNAの「断片化した種」の存在です。これは、DNAテンプレートからの転写プロセスが早期に終了したために生じるRNA断片です。これらの断片は、注射後に細胞で翻訳された場合、不完全なスパイクタンパク質を生成し、予測できない三次元構造の変化をもたらし、生理学的な影響は、よくても中立、悪くても細胞機能に悪影響を及ぼすことになります。市販されている製品には、このような断片化されたRNAが、臨床試験で使用された製品よりもかなり多く含まれていました。ファイザー社は、このRNA断片は細胞内で速やかに分解されると考えられるため、「おそらく...タンパク質の発現には至らない」と主張しています。しかし、タンパク質の発現を否定するデータは提示されておらず、査読者は「これら(断片化したRNA)の形態は特性が乏しく、タンパク質の発現に関して提供された限られたデータでは、意図したスパイクタンパク質以外のタンパク質やペプチドを翻訳するリスクに関する不確実性を十分に解決できない」とコメントしています(EMA 2020)。断片化されたRNAから生成されたスパイクタンパク質以外のタンパク質がミスフォールドやその他の病的な状態になると断言するものではありませんが、少なくとも、存在するスパイクタンパク質のプリオン関連のコンフォメーション変化を促進する細胞ストレスに寄与すると考えています。
パーキンソン病は、脳内のレビー小体の沈着を伴う神経変性疾患であり、このレビー小体に含まれる主なタンパク質はα-シヌクレインである。そのタンパク質であるαシヌクレインは、特定の条件下で毒性のある可溶性オリゴマーやフィブリルに凝集するという点で、確かにプリオン様である(Lema Tomé et al.2013)。研究によると、ミスフォールドしたαシヌクレインは、まず腸で形成され、そこから迷走神経に沿って脳に移動する。おそらく、ミスフォールドしたタンパク質が発生した死にかけの細胞から放出されるエクソソームの形で移動すると考えられる(Kakarlaら、2020年、Steinerら、2011年)。ミスフォールドを促進する細胞条件には、酸性のpHと炎症性サイトカインの高発現の両方が含まれる。迷走神経を切断するとパーキンソン病から保護されることから、迷走神経がミスフォールドしたタンパク質の脳への伝達に重要であることは明らかである。パーキンソン病に伴う迷走神経の萎縮は、ミスフォールドしたαシヌクレインオリゴマーの腸から脳への輸送に迷走神経が関与していることのさらなる証拠となる(Walter et al.2018)。もう1つの経路は嗅覚神経を介したもので、嗅覚の喪失はパーキンソン病の初期症状である。不吉なことに、嗅覚の低下や喪失は、SARS-CoV-2感染の一般的な症状でもあります。αシヌクレインとスパイクタンパク質の間には多くの類似点があり、ワクチン接種後のプリオン様疾患の可能性を示唆しています。ワクチンに含まれるmRNAが、迷走神経と関係の深い肝臓や脾臓に高濃度に存在することは、すでに明らかになっている。ワクチンに含まれるカチオン性脂質は、ミスフォールドを助長する酸性のpHを作り出し、また、もう一つの素因である強い炎症反応を誘発します。胚中心とは、脾臓などの二次リンパ系臓器にある構造物で、濾胞性樹状細胞がB細胞に抗原を提示し、B細胞が抗体反応を完成させる。研究者たちは、組み換えタンパク質ワクチンとは対照的に、mRNAワクチンは脾臓の胚中心で中和抗体をしっかりと発現させることを明らかにしています(Ledererら、2020年)。しかし、このことは、mRNAワクチンがスパイクタンパク質からプリオンを形成し、エキソソームを介して迷走神経に沿って脳に輸送されるための理想的な状況を誘発することも意味している。ある動物から別の動物へのプリオンの拡散は、まずリンパ組織、特に脾臓に現れるという研究結果がある。分化した濾胞樹状細胞は、ミスフォールドしたプリオンタンパク質を蓄積するため、このプロセスの中心となる(Al-Dybiatら、2019年)。炎症性の反応
International Journal of Vaccine Theory, Practice, and Research2(1), May 10, 2021 ページ|426↑これらの樹状細胞におけるα-シヌクレインの合成を制御し、プリオン形成のリスクを高める。 細胞質に蓄積されたプリオンは、脂質体にパッケージ化され、エクソソームとして放出される(Liu et al.、2017)。これらのエクソソームは最終的に脳に移動し、病気を引き起こす。
International Journal of Vaccine Theory, Practice, and Research2(1), May 10, 2021 ページ|426↑これらの樹状細胞におけるα-シヌクレインの合成を制御し、プリオン形成のリスクを高める。 細胞質に蓄積されたプリオンは、脂質体にパッケージ化され、エクソソームとして放出される(Liu et al.、2017)。これらのエクソソームは最終的に脳に移動し、病気を引き起こす。
インターネット上では、ワクチンを接種した人が、ワクチンを接種していない人の近くにいる人に病気を引き起こす可能性について、かなりの議論がなされています。信じられないかもしれませんが、脾臓の樹状細胞からエクソソームが放出され、その中にはミスフォールドしたスパイクタンパク質が含まれており、他のプリオン再形成タンパク質と複合体になっています。このエクソソームは遠くまで移動することができる。肺から放出されたエクソソームが近くの人に吸い込まれることも想像に難くありません。バイオンテック社が実施したファイザー社のmRNAワクチンに関する第1/2/3相試験では、試験プロトコルにワクチンへの二次暴露の可能性を想定していました(バイオンテック社、2020年)。このプロトコールには、「妊娠中の曝露」を研究参加者が報告するという要件が含まれていました。そして、"妊娠中の環境曝露 "の例として、"吸入または皮膚接触による試験介入への曝露 "を挙げています。さらに、「男性の家族や医療従事者が、吸入または皮膚接触により試験介入にさらされた後、妊娠前または妊娠前後にパートナーの女性を暴露する」という2段階の間接暴露を提案した。
興味深い仮説がNatureに掲載された論文で提案されています。その論文では、免疫抑制効果のあるがん化学療法薬を服用していたがん患者が重篤なCOVID-19病に罹患したケースが紹介されています(Kempら、2021年)。この患者は、入院後101日間生存し、最終的にウイルスとの戦いで屈しました。この患者は101日間の間、常にウイルスを排出していたため、感染拡大を防ぐために負圧高気密性の感染症隔離室に移されました。入院中、患者はレムデシビルの投与を受け、その後、COVID-19から回復した人から採取した抗体を含む血漿(回復期血漿)を2回投与された。この血漿治療の後、ウイルスは急速に変異し始め、最終的には患者の鼻と喉から採取したサンプルから優勢な新株が出現したことが確認された。免疫不全の患者では、細胞障害性T細胞によるウイルス除去のサポートがほとんど得られない。この突然変異株は、回復した患者から採取した複数単位の回復期血漿に対する感受性が低下することがin vitroの実験で明らかになった。著者らは、患者の免疫反応が弱いためにウイルスを完全に除去することができず、投与された抗体がウイルスの突然変異速度を実際に加速させたと提案した。これにより、「適者生存」プログラムが開始され、最終的には患者の体内に新しい抗体耐性株が蓄積されることになった。この患者では、ウイルスの複製が長期化したことで「ウイルスの免疫逃避」が起こり、同様の耐性を持つ
International Journal of Vaccine Theory, Practice, and Research2(1), May 10, 2021 Page|427strainsは、曝露された集団の中で非常に早く広がる可能性がある(Kemp et al. 実際、現在、イギリス、南アフリカ、ブラジルで発生している感染力の高い新種の株を作り出すために、同様のプロセスが働いている可能性は十分にあります。今回の実験では、mRNAワクチンに関連して、少なくとも2つの懸念があります。1つ目は、免疫力の低下した患者への感染が続くと、ワクチンで誘導される抗体に耐性のある新型株が続々と出現し、ワクチンがすぐに陳腐化して、国民に再度大量のワクチン接種が求められる可能性があるということです。すでに、ファイザー社の研究者が発表した研究では、これらの変異株の多くに対してワクチンの効果が低下することが示されています。南アフリカ株に対するワクチンの効果は、オリジナル株の2/3に過ぎませんでした(Liu et al.、2021年)。ワクチンに反応して抗体を産生することは考えられますが、その抗体は細胞障害性T細胞の機能が低下しているため、COVID-19にさらされると病気を抑えることができなくなります。このシナリオは、免疫不全の患者に回復期の血漿を投与するのとあまり変わらないので、同じように、より大きなスケールで抗体耐性株の進化を引き起こすかもしれません。 この可能性を利用して、数ヶ月ごとにワクチンを繰り返し接種し、ワクチンにコード化されたウイルスの亜種の数を増やすことが主張されるでしょう。 これは、おそらく我々が負けるであろう軍拡競争である。
International Journal of Vaccine Theory, Practice, and Research2(1), May 10, 2021 Page|427strainsは、曝露された集団の中で非常に早く広がる可能性がある(Kemp et al. 実際、現在、イギリス、南アフリカ、ブラジルで発生している感染力の高い新種の株を作り出すために、同様のプロセスが働いている可能性は十分にあります。今回の実験では、mRNAワクチンに関連して、少なくとも2つの懸念があります。1つ目は、免疫力の低下した患者への感染が続くと、ワクチンで誘導される抗体に耐性のある新型株が続々と出現し、ワクチンがすぐに陳腐化して、国民に再度大量のワクチン接種が求められる可能性があるということです。すでに、ファイザー社の研究者が発表した研究では、これらの変異株の多くに対してワクチンの効果が低下することが示されています。南アフリカ株に対するワクチンの効果は、オリジナル株の2/3に過ぎませんでした(Liu et al.、2021年)。ワクチンに反応して抗体を産生することは考えられますが、その抗体は細胞障害性T細胞の機能が低下しているため、COVID-19にさらされると病気を抑えることができなくなります。このシナリオは、免疫不全の患者に回復期の血漿を投与するのとあまり変わらないので、同じように、より大きなスケールで抗体耐性株の進化を引き起こすかもしれません。 この可能性を利用して、数ヶ月ごとにワクチンを繰り返し接種し、ワクチンにコード化されたウイルスの亜種の数を増やすことが主張されるでしょう。 これは、おそらく我々が負けるであろう軍拡競争である。
mRNAを用いたワクチンは、標的抗原タンパク質の遺伝子コードをDNAウイルスに組み込んで作用させるDNAワクチンよりも、RNAが不用意にヒトゲノムに取り込まれることがないため、安全性が高いと主張されている。
しかし、それが正しいかどうかは全く不明である。
DNA→RNA→タンパク質という古典的なモデルが間違っていることがわかったのである。
現在では、RNAを相補的なDNA(cDNA)に逆転写する遺伝子を持つ、レトロウイルスと呼ばれる大規模なクラスのウイルスが存在することは議論の余地がない。
1975年、ハワード・テミン、レナート・ダルベッコ、デビッド・ボルティモアの3人は、逆転写酵素の発見と、レトロウイルス(ヒト免疫不全ウイルス(HIV)など)がRNAからDNAを作る際に使用する逆転写酵素の合成を行ったことで、ノーベル医学生理学賞を共同受賞した(Temin and Mizutani, 1970, Baltimore, 1970)。
その後、逆転写酵素はレトロウイルスだけのものではないことが判明した。
ヒトゲノムの3分の1以上は、SINEとLINE(それぞれ短核と長核)と呼ばれる謎の移動性DNA要素に費やされている。
LINEはRNAをDNAに変換するための逆転写酵素の機能を提供し、SINEはDNAをゲノムに組み込むためのサポートを行う。
このように、これらの要素は、RNAをDNAに変換してゲノムに組み込み、新しい遺伝子を後世に残すために必要なツールを提供する(Weiner, 2002)。
SINEとLINEは、レトロトランスポゾンと呼ばれる遺伝的要素の一種である。
レトロトランスポゾンは、RNAを介してDNAをゲノム上の新しい場所にコピー&ペーストすることができ、その過程で遺伝子に変化をもたらす可能性がある(Pray, 2008)。
レトロトランスポゾンは「ジャンピング・ジーン」とも呼ばれ、50年以上前にニューヨークのコールド・スプリング・ハーバー研究所の遺伝学者バーバラ・マクリントックによって初めて発見された(McClintock, 1965)。
その後、1983年にはこの業績が認められ、ノーベル賞を受賞している。
驚くべきことに、レトロトランスポゾンは、世代を超えてその領域を拡大することができるようである。
LINEとSINEは、DNAをRNAに変換し、さらに新しいDNAに変換して、ゲノムのATリッチ領域に挿入することで、新しいゲノム部位に侵入する。
これらのLINEとSINEは、長い間、ジャンクDNAと考えられてきたが、その重要な機能が認識されるにつれ、その考えは払拭されてきている。
特に、外因性のRNAを宿主のDNAに取り込む働きがあることが明らかになっている。
マウスのゲノムに見られるレトロウイルス様の繰り返し要素であるIAP(intracisternal A particle)は、ウイルスのRNAをマウスのゲノムに取り込むことができることがわかっている。
外来の非レトロウイルス性RNAウイルスとIAPレトロタンスポソンとの間の組換えにより、ウイルスのRNAが逆転写され、宿主のゲノムに組み込まれた(Geuking et al., 2009)。
さらに、後述するように、新しいSARS-CoV-2ワクチンに含まれるmRNAも、精子に発現するLINEやプラスミドに封入されたビアノン統合cDNAの助けを借りて、世代から世代へと受け継がれる可能性がある。
この予測可能な現象の意味するところは不明だが、広範囲に及ぶ可能性がある。
しかし、それが正しいかどうかは全く不明である。
DNA→RNA→タンパク質という古典的なモデルが間違っていることがわかったのである。
現在では、RNAを相補的なDNA(cDNA)に逆転写する遺伝子を持つ、レトロウイルスと呼ばれる大規模なクラスのウイルスが存在することは議論の余地がない。
1975年、ハワード・テミン、レナート・ダルベッコ、デビッド・ボルティモアの3人は、逆転写酵素の発見と、レトロウイルス(ヒト免疫不全ウイルス(HIV)など)がRNAからDNAを作る際に使用する逆転写酵素の合成を行ったことで、ノーベル医学生理学賞を共同受賞した(Temin and Mizutani, 1970, Baltimore, 1970)。
その後、逆転写酵素はレトロウイルスだけのものではないことが判明した。
ヒトゲノムの3分の1以上は、SINEとLINE(それぞれ短核と長核)と呼ばれる謎の移動性DNA要素に費やされている。
LINEはRNAをDNAに変換するための逆転写酵素の機能を提供し、SINEはDNAをゲノムに組み込むためのサポートを行う。
このように、これらの要素は、RNAをDNAに変換してゲノムに組み込み、新しい遺伝子を後世に残すために必要なツールを提供する(Weiner, 2002)。
SINEとLINEは、レトロトランスポゾンと呼ばれる遺伝的要素の一種である。
レトロトランスポゾンは、RNAを介してDNAをゲノム上の新しい場所にコピー&ペーストすることができ、その過程で遺伝子に変化をもたらす可能性がある(Pray, 2008)。
レトロトランスポゾンは「ジャンピング・ジーン」とも呼ばれ、50年以上前にニューヨークのコールド・スプリング・ハーバー研究所の遺伝学者バーバラ・マクリントックによって初めて発見された(McClintock, 1965)。
その後、1983年にはこの業績が認められ、ノーベル賞を受賞している。
驚くべきことに、レトロトランスポゾンは、世代を超えてその領域を拡大することができるようである。
LINEとSINEは、DNAをRNAに変換し、さらに新しいDNAに変換して、ゲノムのATリッチ領域に挿入することで、新しいゲノム部位に侵入する。
これらのLINEとSINEは、長い間、ジャンクDNAと考えられてきたが、その重要な機能が認識されるにつれ、その考えは払拭されてきている。
特に、外因性のRNAを宿主のDNAに取り込む働きがあることが明らかになっている。
マウスのゲノムに見られるレトロウイルス様の繰り返し要素であるIAP(intracisternal A particle)は、ウイルスのRNAをマウスのゲノムに取り込むことができることがわかっている。
外来の非レトロウイルス性RNAウイルスとIAPレトロタンスポソンとの間の組換えにより、ウイルスのRNAが逆転写され、宿主のゲノムに組み込まれた(Geuking et al., 2009)。
さらに、後述するように、新しいSARS-CoV-2ワクチンに含まれるmRNAも、精子に発現するLINEやプラスミドに封入されたビアノン統合cDNAの助けを借りて、世代から世代へと受け継がれる可能性がある。
この予測可能な現象の意味するところは不明だが、広範囲に及ぶ可能性がある。
また、mRNAワクチンに含まれるRNAが、レトロウイルスの助けを借りてヒトのゲノムに移行することも懸念されている。
レトロウイルスは、ゲノム情報をRNAの形で保持しているが、そのRNAをDNAに逆転写して宿主のゲノムに挿入するための酵素を持っているウイルスである。
その後、宿主の既存の自然の道具を頼りに、DNAをRNAに戻す翻訳によってウイルスのコピーを生成し、ウイルスRNAがコードするタンパク質を生成して、新鮮なウイルス粒子に組み立てる (Lesbats et al., 2016)。
ヒト内因性レトロウイルス(HERV)は、レトロウイルスに酷似したヒトのDNA内の良性のセクションであり、もともと外因性レトロウイルスであったものが統合される過程でヒトゲノム内の恒久的な配列になったと考えられている。
内在性レトロウイルスは、すべての有顎脊椎動物に豊富に存在し、ヒトゲノムの5〜8%を占めると推定されている。
胎盤と子宮壁との融合や、受精時の精子と卵子の融合ステップに必須となっているシンキュティンというタンパク質は、内在性レトロウイルスタンパク質の好例である。
シンクイティンは、最近同定されたヒト内在性欠損レトロウイルスHERV-Wのエンベロープ遺伝子である(Mi et al., 2000)。
妊娠中、胎児は別の内在性レトロウイルスであるHERV-Rを高レベルで発現しており、母親からの免疫攻撃から胎児を保護しているようである(Luganini and Gribaudo, 2020)。
内在性レトロウイルスの要素は、レトロトランスポゾンによく似ている。
その逆転写酵素は、発現すると、mRNAワクチンからスパイクタンパク質RNAをDNAに変換する理論的能力を持つ。
レトロウイルスは、ゲノム情報をRNAの形で保持しているが、そのRNAをDNAに逆転写して宿主のゲノムに挿入するための酵素を持っているウイルスである。
その後、宿主の既存の自然の道具を頼りに、DNAをRNAに戻す翻訳によってウイルスのコピーを生成し、ウイルスRNAがコードするタンパク質を生成して、新鮮なウイルス粒子に組み立てる (Lesbats et al., 2016)。
ヒト内因性レトロウイルス(HERV)は、レトロウイルスに酷似したヒトのDNA内の良性のセクションであり、もともと外因性レトロウイルスであったものが統合される過程でヒトゲノム内の恒久的な配列になったと考えられている。
内在性レトロウイルスは、すべての有顎脊椎動物に豊富に存在し、ヒトゲノムの5〜8%を占めると推定されている。
胎盤と子宮壁との融合や、受精時の精子と卵子の融合ステップに必須となっているシンキュティンというタンパク質は、内在性レトロウイルスタンパク質の好例である。
シンクイティンは、最近同定されたヒト内在性欠損レトロウイルスHERV-Wのエンベロープ遺伝子である(Mi et al., 2000)。
妊娠中、胎児は別の内在性レトロウイルスであるHERV-Rを高レベルで発現しており、母親からの免疫攻撃から胎児を保護しているようである(Luganini and Gribaudo, 2020)。
内在性レトロウイルスの要素は、レトロトランスポゾンによく似ている。
その逆転写酵素は、発現すると、mRNAワクチンからスパイクタンパク質RNAをDNAに変換する理論的能力を持つ。
人間には数多くの外因性レトロウイルスが寄生しているが、これらのウイルスは多くの場合、宿主に害を与えず、共生していることさえある(Luganini and Gribaudo, 2020)。
外来性ウイルスは実験室で内在性ウイルス(宿主のDNAに永久に組み込まれる)に変換することができる。
ルドルフ・ヤーニッシュ(Jaenisch, 1976)は、着床前のマウス胚にモロニーマウス白血病ウイルス(M-MuLV)を感染させた。
この感染した胚から生まれたマウスは白血病を発症し、ウイルスのDNAが生殖細胞系列に組み込まれて子孫に伝わったという。
ウィルスDNAの宿主ゲノムへの組み込み以外にも、DNAプラスミドをマウス胚の核にマイクロインジェクションすることで、真正に繁殖するトランスジェニックマウスが作れることが1980年に示された(Gordonら、1980)。
プラスミドDNAは、既存の自然なプロセスによってマウスの核ゲノムに組み込まれ、新たに獲得した遺伝情報を子孫のゲノムに残すことができた。
この発見は、それ以来、新たに獲得したヒト遺伝子を発現するように設計されたトランスジェニックマウスの多くの遺伝子工学実験の基礎となっている(Bouabe and Okkenhaug, 2013)。
外来性ウイルスは実験室で内在性ウイルス(宿主のDNAに永久に組み込まれる)に変換することができる。
ルドルフ・ヤーニッシュ(Jaenisch, 1976)は、着床前のマウス胚にモロニーマウス白血病ウイルス(M-MuLV)を感染させた。
この感染した胚から生まれたマウスは白血病を発症し、ウイルスのDNAが生殖細胞系列に組み込まれて子孫に伝わったという。
ウィルスDNAの宿主ゲノムへの組み込み以外にも、DNAプラスミドをマウス胚の核にマイクロインジェクションすることで、真正に繁殖するトランスジェニックマウスが作れることが1980年に示された(Gordonら、1980)。
プラスミドDNAは、既存の自然なプロセスによってマウスの核ゲノムに組み込まれ、新たに獲得した遺伝情報を子孫のゲノムに残すことができた。
この発見は、それ以来、新たに獲得したヒト遺伝子を発現するように設計されたトランスジェニックマウスの多くの遺伝子工学実験の基礎となっている(Bouabe and Okkenhaug, 2013)。
LINEだけでもヒトゲノムの20%以上を占めている。
最も一般的なLINEはLINE-1で、基本的な生物学的プロセスを制御する逆転写酵素をコードしている。
LINE-1は多くの種類の細胞で発現しているが、特に精子では高いレベルで発現している。
精子細胞は、精子を介した遺伝子導入アッセイにより、外因性DNAおよび外因性RNA分子のベクターとして使用することができる。
精子は、外因性のRNAを直接cDNAに逆転写し、このcDNAをパッケージ化したプラスミドを受精卵に送り込むことができる。
これらのプラスミドは、胎児の体内で自己増殖し、胎児の多くの組織に存在することができる。
実際、これらのプラスミドは、成人になっても染色体外構造として生存し、子孫に引き継ぐことができる。
これらのプラスミドは転写能力があり、含まれるDNAによってコードされるタンパク質の合成に使用することができる(Pittoggiら、2006年)。
精子だけでなく、着床前の胚も逆転写酵素を発現しており、その阻害により発生が停止する。
LINE-1はがん細胞でも発現しており、RNA干渉を介してヒトLINE-1をサイレンシングすると、多くのがん細胞株で分化が誘導される。
逆転写酵素は、がん細胞でも生殖細胞でも、新たな遺伝情報の生成に関与している。
多くの腫瘍組織では、高レベルのLINE-1が発現しており、核内に多くの染色体外プラスミドが存在することがわかっている。
悪性グリオーマは中枢神経系の原発腫瘍であり、これらの腫瘍からはDNA、RNA、タンパク質を含むエクソソームが放出され、それが一般循環に乗ることが実験的に示されている(Vaidya and Sugaya, 2020)。
また、LINE-1は、全身性エリテマトーデス、シェーグレン、乾癬などの自己免疫疾患の免疫細胞でも高発現している(Zhang et al.、2020)。
最も一般的なLINEはLINE-1で、基本的な生物学的プロセスを制御する逆転写酵素をコードしている。
LINE-1は多くの種類の細胞で発現しているが、特に精子では高いレベルで発現している。
精子細胞は、精子を介した遺伝子導入アッセイにより、外因性DNAおよび外因性RNA分子のベクターとして使用することができる。
精子は、外因性のRNAを直接cDNAに逆転写し、このcDNAをパッケージ化したプラスミドを受精卵に送り込むことができる。
これらのプラスミドは、胎児の体内で自己増殖し、胎児の多くの組織に存在することができる。
実際、これらのプラスミドは、成人になっても染色体外構造として生存し、子孫に引き継ぐことができる。
これらのプラスミドは転写能力があり、含まれるDNAによってコードされるタンパク質の合成に使用することができる(Pittoggiら、2006年)。
精子だけでなく、着床前の胚も逆転写酵素を発現しており、その阻害により発生が停止する。
LINE-1はがん細胞でも発現しており、RNA干渉を介してヒトLINE-1をサイレンシングすると、多くのがん細胞株で分化が誘導される。
逆転写酵素は、がん細胞でも生殖細胞でも、新たな遺伝情報の生成に関与している。
多くの腫瘍組織では、高レベルのLINE-1が発現しており、核内に多くの染色体外プラスミドが存在することがわかっている。
悪性グリオーマは中枢神経系の原発腫瘍であり、これらの腫瘍からはDNA、RNA、タンパク質を含むエクソソームが放出され、それが一般循環に乗ることが実験的に示されている(Vaidya and Sugaya, 2020)。
また、LINE-1は、全身性エリテマトーデス、シェーグレン、乾癬などの自己免疫疾患の免疫細胞でも高発現している(Zhang et al.、2020)。
驚くべきことに、アルツハイマー病患者の脳から採取した神経細胞には、アミロイド前駆体タンパク質APPの遺伝子の複数の変異体がゲノムに組み込まれており、これらは体細胞遺伝子組み換え(SGR)と呼ばれるプロセスで作られることが実証されている(Kaeserら、2020年)。
SGRには、遺伝子の転写、DNA鎖の切断、逆転写酵素の活性化が必要であり、これらすべてがよく知られたアルツハイマー病の危険因子によって促進される可能性がありる。
APPをコードするDNAは、RNAに逆転写された後、再びDNAに転写され、鎖状に切断された部位でゲノムに組み込まれる。
RNAは変異の影響を受けやすいので、モザイク状にコピーされたDNAには多くの変異型遺伝子が含まれており、細胞はAPPの複数の変異型を生み出すことができるモザイク状になる。
アルツハイマー病患者の神経細胞の染色体には、5億塩基対もの過剰なDNAが含まれていた(Bushman et al.、2015)。
MITとハーバード大学の研究者たちは、2021年に不穏な論文を発表し、SARS-CoV-2のRNAがDNAに逆転写され、ヒトのDNAに統合されるという強力な証拠を示した(Zhang et al.、2021年)。
この論文は、SARS-CoV-2のRNAがDNAに逆転写され、ヒトのDNAに統合されるという強力な証拠を示している(Zhang et al., 2021)。
著者らは、COVID-19から回復した患者から、ウイルスのDNA配列と細胞のDNA配列が融合したキメラ転写産物を発見した。
COVID-19は、重症化するとサイトカインストームを引き起こすことが多いため、サイトカインを含む細胞培養液を用いたin vitro試験で、逆転写酵素の活性が高まっている可能性を確認した。
その結果、サイトカインに反応して、内因性LINE-1の発現が2〜3倍に増加することがわかった。
ヒトのDNAに取り込まれたウイルス由来の外因性RNAは、感染が解消された後もウイルスタンパク質の断片をいつまでも生成する可能性があり、PCR検査では偽陽性となる。
SGRには、遺伝子の転写、DNA鎖の切断、逆転写酵素の活性化が必要であり、これらすべてがよく知られたアルツハイマー病の危険因子によって促進される可能性がありる。
APPをコードするDNAは、RNAに逆転写された後、再びDNAに転写され、鎖状に切断された部位でゲノムに組み込まれる。
RNAは変異の影響を受けやすいので、モザイク状にコピーされたDNAには多くの変異型遺伝子が含まれており、細胞はAPPの複数の変異型を生み出すことができるモザイク状になる。
アルツハイマー病患者の神経細胞の染色体には、5億塩基対もの過剰なDNAが含まれていた(Bushman et al.、2015)。
MITとハーバード大学の研究者たちは、2021年に不穏な論文を発表し、SARS-CoV-2のRNAがDNAに逆転写され、ヒトのDNAに統合されるという強力な証拠を示した(Zhang et al.、2021年)。
この論文は、SARS-CoV-2のRNAがDNAに逆転写され、ヒトのDNAに統合されるという強力な証拠を示している(Zhang et al., 2021)。
著者らは、COVID-19から回復した患者から、ウイルスのDNA配列と細胞のDNA配列が融合したキメラ転写産物を発見した。
COVID-19は、重症化するとサイトカインストームを引き起こすことが多いため、サイトカインを含む細胞培養液を用いたin vitro試験で、逆転写酵素の活性が高まっている可能性を確認した。
その結果、サイトカインに反応して、内因性LINE-1の発現が2〜3倍に増加することがわかった。
ヒトのDNAに取り込まれたウイルス由来の外因性RNAは、感染が解消された後もウイルスタンパク質の断片をいつまでも生成する可能性があり、PCR検査では偽陽性となる。
BVD(Bovine Viral Diarrhea)は、世界中の牛が罹患するウイルス性の感染症である。
BVDは、小型で球形の一本鎖のエンベロープ型RNAウイルスであるペスティウイルスの一種である。
この病気は、消化器系、呼吸器系、生殖器系の病気と関連している。
BVDの特徴は、ウイルスが妊娠中のダムの胎盤を通過することである。
その結果、子牛は細胞内のウイルス粒子を「自分」と勘違いして生まれてくる。
子牛の免疫システムはウイルスを異物として認識することができず、その結果、子牛は生涯にわたって大量のウイルスを排出し、牛群全体を感染させる可能性がある。
このようなキャリアの子牛を特定し、感染を抑制するために群れから淘汰することが広く行われている(Khodakaram-Tafti & Farjanikish, 2017)。
将来的には、女性がSARS-CoV-2のmRNAワクチンを接種し、その直後に子供を妊娠するという危険な状況が発生することも起こりうると思われる。
精子は、ワクチンからRNAが埋め込まれたリポソームを自由に取り込み、LINE-1を使ってそれをDNAに変換する。
その後、精子はスパイクタンパク質のコードを含むプラスミドを生成し、このプラスミドが上述のプロセスを経て受精卵に取り込まれる。
生まれてきた赤ちゃんは、免疫システムがスパイクタンパク質を「自己」とみなして、抗体を作ることができない可能性がある。
万が一、その乳児がSARS-CoV-2に感染した場合、乳児の免疫システムはウイルスに対する防御機能を持たないため、ウイルスは乳児の体内で自由に増殖すると考えられる。
このような状況では、論理的には乳児はスーパースプレッダーとなる。
もちろん、これは現時点では推測の域を出ませんが、レトロトランスポゾン、精子、受精、免疫系、ウイルスについての知見から、このようなシナリオを否定することはできないと考えられる。
本来プラスミドであるDNAベクターワクチンの遺伝子要素が、宿主に組み込まれることは、すでにマウス実験で証明されている (Wang et al., 2004)。
実際、このようなプロセスは、後天的な形質の継承として定義されるラマルク進化の基礎として示唆されている(Steele, 1980)。
かつて「ジャンクDNA」と呼ばれていたものがジャンクではないことがわかったのは、フラクタルゲノミクスに基づいた人間の言語、生物学、遺伝学の新しい哲学的パラダイムから生まれた成果のひとつである(Pellionisz, 2012)。
このパラダイムは、人体の多くの枝分かれした構造の正常な発達の非常に反復的なプロセスにおいて、「フラクタルテンプレートの反復」として実現される「真の物語表現」(TNRs; Oller, 2010)の関与と関連している。
これらのプロセスは、肺、腎臓、静脈や動脈、そして最も重要な脳に数多く存在する。
mRNAワクチンは、SARS-CoV-2のスパイクタンパクのコードをヒトのDNAに組み込む可能性のある実験的な遺伝子治療法である。
このDNAコードは、タンパク質を含んだ感染粒子のコピーを大量に合成するよう指示する可能性があり、展開される物語に複数の偽シグナルを挿入し、予測できない結果をもたらす可能性がある。
BVDは、小型で球形の一本鎖のエンベロープ型RNAウイルスであるペスティウイルスの一種である。
この病気は、消化器系、呼吸器系、生殖器系の病気と関連している。
BVDの特徴は、ウイルスが妊娠中のダムの胎盤を通過することである。
その結果、子牛は細胞内のウイルス粒子を「自分」と勘違いして生まれてくる。
子牛の免疫システムはウイルスを異物として認識することができず、その結果、子牛は生涯にわたって大量のウイルスを排出し、牛群全体を感染させる可能性がある。
このようなキャリアの子牛を特定し、感染を抑制するために群れから淘汰することが広く行われている(Khodakaram-Tafti & Farjanikish, 2017)。
将来的には、女性がSARS-CoV-2のmRNAワクチンを接種し、その直後に子供を妊娠するという危険な状況が発生することも起こりうると思われる。
精子は、ワクチンからRNAが埋め込まれたリポソームを自由に取り込み、LINE-1を使ってそれをDNAに変換する。
その後、精子はスパイクタンパク質のコードを含むプラスミドを生成し、このプラスミドが上述のプロセスを経て受精卵に取り込まれる。
生まれてきた赤ちゃんは、免疫システムがスパイクタンパク質を「自己」とみなして、抗体を作ることができない可能性がある。
万が一、その乳児がSARS-CoV-2に感染した場合、乳児の免疫システムはウイルスに対する防御機能を持たないため、ウイルスは乳児の体内で自由に増殖すると考えられる。
このような状況では、論理的には乳児はスーパースプレッダーとなる。
もちろん、これは現時点では推測の域を出ませんが、レトロトランスポゾン、精子、受精、免疫系、ウイルスについての知見から、このようなシナリオを否定することはできないと考えられる。
本来プラスミドであるDNAベクターワクチンの遺伝子要素が、宿主に組み込まれることは、すでにマウス実験で証明されている (Wang et al., 2004)。
実際、このようなプロセスは、後天的な形質の継承として定義されるラマルク進化の基礎として示唆されている(Steele, 1980)。
かつて「ジャンクDNA」と呼ばれていたものがジャンクではないことがわかったのは、フラクタルゲノミクスに基づいた人間の言語、生物学、遺伝学の新しい哲学的パラダイムから生まれた成果のひとつである(Pellionisz, 2012)。
このパラダイムは、人体の多くの枝分かれした構造の正常な発達の非常に反復的なプロセスにおいて、「フラクタルテンプレートの反復」として実現される「真の物語表現」(TNRs; Oller, 2010)の関与と関連している。
これらのプロセスは、肺、腎臓、静脈や動脈、そして最も重要な脳に数多く存在する。
mRNAワクチンは、SARS-CoV-2のスパイクタンパクのコードをヒトのDNAに組み込む可能性のある実験的な遺伝子治療法である。
このDNAコードは、タンパク質を含んだ感染粒子のコピーを大量に合成するよう指示する可能性があり、展開される物語に複数の偽シグナルを挿入し、予測できない結果をもたらす可能性がある。
実験的に開発されたmRNAワクチンは、大きな利益をもたらす可能性があると言われているが、その一方で、悲劇的、あるいは破滅的な不測の事態を招く可能性も秘めている。
SARS-CoV-2に対するmRNAワクチンは大々的に導入されているが、その普及には懸念すべき点が多くある。
ここでは、それらの懸念事項のすべてではないが、いくつかを確認した。
これらの懸念事項は潜在的に深刻であり、何年も、あるいは世代を超えても明らかにならない可能性があることを強調したい。
この論文で述べられた有害な可能性を十分に排除するために、私たちは少なくとも以下のような研究・監視方法を採用することを推奨する。
●潤沢な資金を投入して、mRNAワクチンに関連する有害事象の詳細なデータを収集するための国家的な取り組みを行い、ワクチン接種後の最初の数週間を超えて追跡調査を行う。
●ワクチンを受けた人たちの自己抗体検査を繰り返す。
検査する自己抗体は標準化されていて、以前に記録された抗体やスパイクタンパクによって誘発される可能性のある自己抗体に基づいている必要がある。
これには、リン脂質、コラーゲン、アクチン、サイロペルオキシダーゼ(TPO)、ミエリン塩基性タンパク質、組織トランスグルタミナーゼなどに対する自己抗体が含まれる。
●サイトカインのバランスと関連する生物学的効果に関連する免疫学的プロファイリング。
最低でもIL-6、INF-α、D-ダイマー、フィブリノーゲン、C-反応性タンパクなどの検査が必要である。
●mRNAワクチンを接種した集団と接種しなかった集団を比較し、接種した集団で感染率が低下し、症状が軽快したことを確認し、同時に同じ2つの集団で様々な自己免疫疾患やプリオン病の発症率を比較する研究。
●ワクチンを接種していない人が、ワクチンを接種した人からワクチン特有のスパイク蛋白質を近距離で獲得することが可能かどうかを評価する研究。
●mRNAナノ粒子が精子に取り込まれ、cDNAプラスミドに変換されるかどうかを評価するin vitro研究。
●妊娠直前にワクチンを接種することで、スパイクタンパクをコードするプラスミドが組織内に存在し、ゲノムに組み込まれる可能性があるかどうかを調べる動物実験
●スパイクタンパクの脳、心臓、精巣などへの毒性をより深く理解することを目的としたin vitro実験。
集団予防接種をめぐる公共政策は、一般的に、新規mRNAワクチンのリスク/ベネフィット比が「スラムダンク」であるという前提で進められてきた。
COVID-19の国際的な緊急事態宣言を受けて、大規模なワクチン接種キャンペーンが順調に行われている中で、世界規模でのワクチン実験に突入したのである。
少なくとも、これらの実験で得られたデータを活用して、この新しい未検証の技術についてもっと知るべきだと思う。
最後に、当たり前のことだが、悲劇的に無視されている提案として、政府は国民に対して、安全で手頃な方法で自然に免疫システムを高めることを奨励すべきである。
例えば、ビタミンDレベルを上げるために日光を浴びること(Ali, 2020)、化学物質を含む加工食品ではなく、主に有機栽培された全粒粉の食品を食べること(Rico-Campàら, 2019)などである。
また、ビタミンA、ビタミンC、ビタミンK2の供給源となる食品を食べることも奨励すべきである。
これらのビタミンの欠乏はCOVID-19による悪い結果と関連しているからである(Goddek、2020; Sarohan、2020)。
SARS-CoV-2に対するmRNAワクチンは大々的に導入されているが、その普及には懸念すべき点が多くある。
ここでは、それらの懸念事項のすべてではないが、いくつかを確認した。
これらの懸念事項は潜在的に深刻であり、何年も、あるいは世代を超えても明らかにならない可能性があることを強調したい。
この論文で述べられた有害な可能性を十分に排除するために、私たちは少なくとも以下のような研究・監視方法を採用することを推奨する。
●潤沢な資金を投入して、mRNAワクチンに関連する有害事象の詳細なデータを収集するための国家的な取り組みを行い、ワクチン接種後の最初の数週間を超えて追跡調査を行う。
●ワクチンを受けた人たちの自己抗体検査を繰り返す。
検査する自己抗体は標準化されていて、以前に記録された抗体やスパイクタンパクによって誘発される可能性のある自己抗体に基づいている必要がある。
これには、リン脂質、コラーゲン、アクチン、サイロペルオキシダーゼ(TPO)、ミエリン塩基性タンパク質、組織トランスグルタミナーゼなどに対する自己抗体が含まれる。
●サイトカインのバランスと関連する生物学的効果に関連する免疫学的プロファイリング。
最低でもIL-6、INF-α、D-ダイマー、フィブリノーゲン、C-反応性タンパクなどの検査が必要である。
●mRNAワクチンを接種した集団と接種しなかった集団を比較し、接種した集団で感染率が低下し、症状が軽快したことを確認し、同時に同じ2つの集団で様々な自己免疫疾患やプリオン病の発症率を比較する研究。
●ワクチンを接種していない人が、ワクチンを接種した人からワクチン特有のスパイク蛋白質を近距離で獲得することが可能かどうかを評価する研究。
●mRNAナノ粒子が精子に取り込まれ、cDNAプラスミドに変換されるかどうかを評価するin vitro研究。
●妊娠直前にワクチンを接種することで、スパイクタンパクをコードするプラスミドが組織内に存在し、ゲノムに組み込まれる可能性があるかどうかを調べる動物実験
●スパイクタンパクの脳、心臓、精巣などへの毒性をより深く理解することを目的としたin vitro実験。
集団予防接種をめぐる公共政策は、一般的に、新規mRNAワクチンのリスク/ベネフィット比が「スラムダンク」であるという前提で進められてきた。
COVID-19の国際的な緊急事態宣言を受けて、大規模なワクチン接種キャンペーンが順調に行われている中で、世界規模でのワクチン実験に突入したのである。
少なくとも、これらの実験で得られたデータを活用して、この新しい未検証の技術についてもっと知るべきだと思う。
最後に、当たり前のことだが、悲劇的に無視されている提案として、政府は国民に対して、安全で手頃な方法で自然に免疫システムを高めることを奨励すべきである。
例えば、ビタミンDレベルを上げるために日光を浴びること(Ali, 2020)、化学物質を含む加工食品ではなく、主に有機栽培された全粒粉の食品を食べること(Rico-Campàら, 2019)などである。
また、ビタミンA、ビタミンC、ビタミンK2の供給源となる食品を食べることも奨励すべきである。
これらのビタミンの欠乏はCOVID-19による悪い結果と関連しているからである(Goddek、2020; Sarohan、2020)。
本ウェブサイトおよびIJVTPRに掲載されている情報は、何らかの形で言及されている可能性のある人間の状態または医療処置について、診断、推奨される治療、予防、または治療を意図したものではありません。
参照される可能性のある病的な状態、手順、プロトコルの影響を受ける人の親、保護者、介護者、臨床医、または親族である可能性のある利用者および読者は、具体的な適用に関して自ら判断を下す必要があります。
寄稿した著者、編集者、および本ウェブサイトや本誌に何らかの形で関係する人物は、本ウェブサイトやIJVTPRに掲載されている情報、結論、研究結果、意見、誤り、または記述をいかなる状況で使用または適用した場合でも、それに起因するいかなる損害、金銭的損失、身体的傷害、またはその他のペナルティについても、いかなる人物または団体に対しても、一切の責任を負いません。
提示された資料は、それを検討することに興味を持ったすべてのユーザーに自由に提供されますが、その一部をどのように適用するかは、閲覧者/ユーザーの唯一の責任です。
引用・転載する場合は、出典・著者のクレジットを表示し、クリエイティブ・コモンズ・ライセンス4.0 NC NDの非営利・派生物禁止の要件に準拠することが求められます。
参照される可能性のある病的な状態、手順、プロトコルの影響を受ける人の親、保護者、介護者、臨床医、または親族である可能性のある利用者および読者は、具体的な適用に関して自ら判断を下す必要があります。
寄稿した著者、編集者、および本ウェブサイトや本誌に何らかの形で関係する人物は、本ウェブサイトやIJVTPRに掲載されている情報、結論、研究結果、意見、誤り、または記述をいかなる状況で使用または適用した場合でも、それに起因するいかなる損害、金銭的損失、身体的傷害、またはその他のペナルティについても、いかなる人物または団体に対しても、一切の責任を負いません。
提示された資料は、それを検討することに興味を持ったすべてのユーザーに自由に提供されますが、その一部をどのように適用するかは、閲覧者/ユーザーの唯一の責任です。
引用・転載する場合は、出典・著者のクレジットを表示し、クリエイティブ・コモンズ・ライセンス4.0 NC NDの非営利・派生物禁止の要件に準拠することが求められます。