最終更新:
 kazuchan_withlove 2021年12月30日(木) 16:17:06履歴
kazuchan_withlove 2021年12月30日(木) 16:17:06履歴
SARS-CoV-2が脳に及ぼす影響と現在使用されているワクチンへの示唆
How Does Severe Acute Respiratory Syndrome-Coronavirus-2 Affect the Brain and Its Implications for the Vaccines Currently in Use
フィリップ・R・オールドフィールド (科学・規制コンサルタント、リゴー、QC J0P 1P0、カナダ)
ジェニファー・ヒバード (トロント大学歯学部、トロント、ON M5G 1X3、カナダ)
バイラム・W・ブライドル (ゲルフ大学病理生物学教室、ゲルフ、ON N1G 2W1、カナダ)
Vaccines (2022, 10)
https://doi.org/10.3390/vaccines10010001
Received: 2021年11月8日 / 改訂:2021年12月15日 / 受理済 2021年12月17日 / 発行:2021年12月21日 Open Access)
(本論文は、特集「コロナウイルス:ワクチンとその他の治療法」」に属するものです。
*本記事はDeepL翻訳で日本語化しました。誤訳がある可能性がありますので、正確には原著をご覧ください。
目次
How Does Severe Acute Respiratory Syndrome-Coronavirus-2 Affect the Brain and Its Implications for the Vaccines Currently in Use
フィリップ・R・オールドフィールド (科学・規制コンサルタント、リゴー、QC J0P 1P0、カナダ)
ジェニファー・ヒバード (トロント大学歯学部、トロント、ON M5G 1X3、カナダ)
バイラム・W・ブライドル (ゲルフ大学病理生物学教室、ゲルフ、ON N1G 2W1、カナダ)
Vaccines (2022, 10)
https://doi.org/10.3390/vaccines10010001
Received: 2021年11月8日 / 改訂:2021年12月15日 / 受理済 2021年12月17日 / 発行:2021年12月21日 Open Access)
(本論文は、特集「コロナウイルス:ワクチンとその他の治療法」」に属するものです。
*本記事はDeepL翻訳で日本語化しました。誤訳がある可能性がありますので、正確には原著をご覧ください。
目次
本ミニレビュ-では、重症急性呼吸器症候群コロナウイルス2型(SARS-CoV-2)が脳に及ぼす影響のメカニズムについて、神経症状を呈する患者におけるスパイク蛋白の役割に重点を置いて解説している。感染後、神経学的合併症の既往がある患者は、パーキンソン病やレビー小体型認知症など、α-シヌクレイン・プリオンに関連する長期神経疾患を発症するリスクが高い可能性がある。SARS-CoV-2に由来し、現在使用されているワクチンから生成されるスパイクタンパク質は、血液脳関門を通過することができるだけでなく、脳内で炎症や血栓を引き起こす可能性があることを示す有力な証拠が発表されている。したがって、ワクチンによるスパイク蛋白の発現が注射部位と排出リンパ節に限定されない場合、SARS-CoV-2に感染した後に神経学的合併症を示す患者の場合と同じように、接種後に長期にわたる影響を及ぼす可能性がある。しかし、確定的な結論を出すには、さらなる研究が必要である。
キーワード:重症急性呼吸器症候群-コロナウイルス-2(SARS-CoV-2);2019年に発生した新規コロナウイルス疾患(COVID-19);サイトカイン;スパイクタンパク質;血液脳関門(BBB);アンジオテンシン変換酵素2(ACE2);パーキンソン病;レビー小体型認知症;適正検査基準(Good Laboratory Practice)
キーワード:重症急性呼吸器症候群-コロナウイルス-2(SARS-CoV-2);2019年に発生した新規コロナウイルス疾患(COVID-19);サイトカイン;スパイクタンパク質;血液脳関門(BBB);アンジオテンシン変換酵素2(ACE2);パーキンソン病;レビー小体型認知症;適正検査基準(Good Laboratory Practice)
重症急性呼吸器症候群-コロナウイルス-2(SARS-CoV-2)は、2019年に発生した新型コロナウイルス感染症の原因ウイルスである(COVID-19)。世界的なパンデミック宣言を促し、1年以上続いている。ウェブサイト「Worldometer」(https://www.worldometers.info/coronavirus/ 2021年12月14日アクセス)によると、COVID-19による患者数は2億7170万人、死亡者数は530万人、回復者数は2億4430万人となっている。COVID-19は、主に呼吸器系の病気とされている。しかしながら、一般的なインフルエンザとは異なり、一部の患者では脳を含む他の臓器も深刻な影響を受けている[1]。SARS-CoV-2には脳に直接影響を与える能力があり、嗅覚・味覚の喪失、激しい頭痛、衰弱した疲労、明晰に考えることができない(ブレイン・フォグ)、発作、脳卒中、さまざまな程度の麻痺といった新しい症状が現れることが証拠によって示されている[2]。このテーマについては、すでに信頼できる数多くの研究が発表されており、この記事で紹介している。前臨床研究の結果と、いくつかの患者の症例から、そのメカニズムについて説明する。
コロナウイルスが初めてヒトに感染したのは、1965年の感冒であった。その後、2002年にSARS-CoV(SARSの原因ウイルス)の発生があり、10年後に中東呼吸器症候群(MERS)-CoV(MERSの原因ウイルス)の発生があった(図1)。当時、これらの流行は、それぞれ9.5%と34.4%の症例致死率で世界的な関心を呼んだ[3]。SARSとMERSの患者致死率はCOVID-19の2.3%より高かったが[3]、前者2つの感染症の発生は収束した(表1)。では、これらの過去の感染症とSARS-CoV-2ウイルスの共通点は何だろうか。
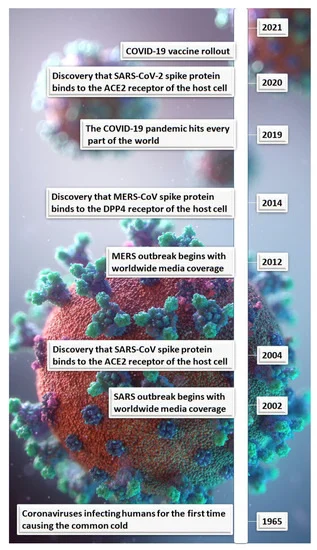
図1. コロナウイルスとスパイク蛋白質受容体標的の年表
表1. 重症急性呼吸器症候群コロナウイルス(SARS-CoV)、中東呼吸器症候群コロナウイルス(MERS-CoV)、SARS-CoV-2の特徴

MERS-CoVはジペプチジルペプチダーゼ4受容体(CD26とも呼ばれる)に結合する。MERSが致命的だったのは、ウイルスが結合する受容体が宿主の免疫系の調節に関与していたことである。T細胞はCD26受容体との結合を阻害され、その結果、適応免疫反応の遅延を引き起こしたのである。MERS-CoVはマクロファージ上のCD26受容体に結合し、自然免疫反応を維持させるが、その結果、患者は発熱し、激しい炎症反応が始まり、CD26を発現する免疫系の細胞が死滅し、症状が悪化し、予後が悪くなった[8,9](表1)。
SARS-CoVもSARS-CoV-2も宿主細胞上の同じ受容体であるアンジオテンシン変換酵素2(ACE2)を標的としており、臨床症状が似ているのはこのためと思われる(表1)。SARSやCOVID-19では、患者はある瞬間元気になっても、短期間のうちに呼吸困難を起こし、酸素吸入や入院を必要とすることがある。このような患者に何が起こっているのかを知るには、血圧と体液のバランスを調整するアンジオテンシン-レンニン系の役割を考える必要がある。SARS-CoV-2のスパイクタンパク質がACE2受容体と結合すると、血圧と体液バランスの生体制御機構が破壊され、肺に水分が蓄積して肺炎や呼吸不全につながる[10]。このように、ウイルスが体に悪影響を及ぼすだけでなく、医師が効果的な治療を行うことが困難であることを物語っている。アンジオテンシン-レンニン系は冗長性を持っていない。したがって、いったんこのシステムが制御不能になると、肺に液体が蓄積することは避けられない [10]。この場合、そのような患者は呼吸機能が急速に低下し、呼吸困難による低酸素飽和度、永久的な肺の損傷、そしておそらく低酸素による他の臓器の損傷を経験し、人工呼吸によってさらに悪化することが予想される [11]。SARS-CoVとMERS-CoVの長期的影響は、永久的な肺の損傷による呼吸障害と、最初の感染からの回復後数年間、その人の日常生活に直接影響を与えるうつ病などの心理的問題と関連していることが知られている。これらの患者の一部は、フルタイムの仕事に復帰することができない[12,13]。SARS-CoV-2はSARS-CoVと同じ受容体を標的としているので、重症入院患者のフォローアップが推奨される。
したがって、これらの疾患の発症には、ウイルスのスパイク蛋白が重要な役割を担っていると結論づけることができる。また、これらの例は、効果的な治療を促進するために、疾患の分子基盤を明らかにする必要性を示している。

図1. コロナウイルスとスパイク蛋白質受容体標的の年表
表1. 重症急性呼吸器症候群コロナウイルス(SARS-CoV)、中東呼吸器症候群コロナウイルス(MERS-CoV)、SARS-CoV-2の特徴

MERS-CoVはジペプチジルペプチダーゼ4受容体(CD26とも呼ばれる)に結合する。MERSが致命的だったのは、ウイルスが結合する受容体が宿主の免疫系の調節に関与していたことである。T細胞はCD26受容体との結合を阻害され、その結果、適応免疫反応の遅延を引き起こしたのである。MERS-CoVはマクロファージ上のCD26受容体に結合し、自然免疫反応を維持させるが、その結果、患者は発熱し、激しい炎症反応が始まり、CD26を発現する免疫系の細胞が死滅し、症状が悪化し、予後が悪くなった[8,9](表1)。
SARS-CoVもSARS-CoV-2も宿主細胞上の同じ受容体であるアンジオテンシン変換酵素2(ACE2)を標的としており、臨床症状が似ているのはこのためと思われる(表1)。SARSやCOVID-19では、患者はある瞬間元気になっても、短期間のうちに呼吸困難を起こし、酸素吸入や入院を必要とすることがある。このような患者に何が起こっているのかを知るには、血圧と体液のバランスを調整するアンジオテンシン-レンニン系の役割を考える必要がある。SARS-CoV-2のスパイクタンパク質がACE2受容体と結合すると、血圧と体液バランスの生体制御機構が破壊され、肺に水分が蓄積して肺炎や呼吸不全につながる[10]。このように、ウイルスが体に悪影響を及ぼすだけでなく、医師が効果的な治療を行うことが困難であることを物語っている。アンジオテンシン-レンニン系は冗長性を持っていない。したがって、いったんこのシステムが制御不能になると、肺に液体が蓄積することは避けられない [10]。この場合、そのような患者は呼吸機能が急速に低下し、呼吸困難による低酸素飽和度、永久的な肺の損傷、そしておそらく低酸素による他の臓器の損傷を経験し、人工呼吸によってさらに悪化することが予想される [11]。SARS-CoVとMERS-CoVの長期的影響は、永久的な肺の損傷による呼吸障害と、最初の感染からの回復後数年間、その人の日常生活に直接影響を与えるうつ病などの心理的問題と関連していることが知られている。これらの患者の一部は、フルタイムの仕事に復帰することができない[12,13]。SARS-CoV-2はSARS-CoVと同じ受容体を標的としているので、重症入院患者のフォローアップが推奨される。
したがって、これらの疾患の発症には、ウイルスのスパイク蛋白が重要な役割を担っていると結論づけることができる。また、これらの例は、効果的な治療を促進するために、疾患の分子基盤を明らかにする必要性を示している。
まれではあるが、COVID-19に伴う重篤な神経症状の多くは、低酸素、サイトカイン・ストーム、血栓によるもので、これらはすべて脳の神経細胞を損傷させる一因となるものである。嗅覚と味覚の喪失(無嗅覚症)、激しい頭痛、衰弱した疲労、明晰に考えることの困難(脳霧)、発作、脳卒中、およびさまざまな程度の麻痺は、これらの症状の一部である[2]。
しばしば、COVID-19の最初の症状の1つは、嗅覚と味覚の喪失である。嗅神経は解剖学的に脳に近いため、この神経経路は、病気の初期段階でSARS-CoV-2が脳に侵入するための理想的な手段であると考えられる[14]。しかし、SARS-CoV-2がこの経路で脳内に拡散するかどうかは、まだ不明である。嗅覚上皮のサステイン細胞や幹細胞がACE2を発現しており、SARS-CoV-2に感染しやすいことが報告されている。逆に、嗅覚神経細胞はACE2を発現しておらず、SARS-CoV-2は脳にアクセスできないことが示唆された[15,16](未査読)。したがって、嗅覚上皮の損傷は、神経細胞の損傷ではなく、臨床的な無嗅覚症の根底にあると結論づけられた。
しかしながら、病気の進行に伴いSARS-CoV-2が脳に侵入する別の経路が存在する[14]。SARS-CoV-2のスパイクタンパク質は、脳の血管系の内皮細胞が発現するACE2受容体に結合し、膜貫通型プロテアーゼ・セリン2という酵素によって、これらの細胞への侵入を促進する。内皮細胞がウイルスによって傷つけられると、サイトカインストームと呼ばれる炎症反応が起こり、血中の好中球やマクロファージ、脳内のミクログリアやアストロサイトが活性化される。内皮の損傷や、スパイク蛋白/ACE2相互作用によるSARS-CoV-2による血小板の直接活性化[17]は、微小血栓の形成を促進し、それが血栓に発展する可能性もある。このように、ケモカインである単球走化性タンパク質1とサイトカインによって引き起こされる血液脳関門(BBB)の不安定化により、SARS-CoV-2はBBBを自由に通過することができるようになるのである。
そして、脳内に侵入したウイルスは、増殖の機会を得ることになる。SARS-CoV-2は、ヒトの脳細胞オルガノイドを用いて実証されたように、ニューロン細胞の仕組みを利用して複製する能力を持っている[18]。さらに、COVID-19と診断された患者の脳生検では、SARS-CoV-2がニューロンそのものを標的にして複製することができることが示された[18]。しかし、サイトカインの嵐をもたらす神経炎症が、ミクログリアの活性化をもたらす主要な要因であることが明らかになった。これにより、キヌレニン、キノリン酸、グルタミン酸が増加し、それに伴って神経伝達物質のセロトニン、ドーパミン、ノルエピネフリンが枯渇し、COVID-19やニューロンの損傷に伴う精神神経症状が引き起こされるのである[14]。
しばしば、COVID-19の最初の症状の1つは、嗅覚と味覚の喪失である。嗅神経は解剖学的に脳に近いため、この神経経路は、病気の初期段階でSARS-CoV-2が脳に侵入するための理想的な手段であると考えられる[14]。しかし、SARS-CoV-2がこの経路で脳内に拡散するかどうかは、まだ不明である。嗅覚上皮のサステイン細胞や幹細胞がACE2を発現しており、SARS-CoV-2に感染しやすいことが報告されている。逆に、嗅覚神経細胞はACE2を発現しておらず、SARS-CoV-2は脳にアクセスできないことが示唆された[15,16](未査読)。したがって、嗅覚上皮の損傷は、神経細胞の損傷ではなく、臨床的な無嗅覚症の根底にあると結論づけられた。
しかしながら、病気の進行に伴いSARS-CoV-2が脳に侵入する別の経路が存在する[14]。SARS-CoV-2のスパイクタンパク質は、脳の血管系の内皮細胞が発現するACE2受容体に結合し、膜貫通型プロテアーゼ・セリン2という酵素によって、これらの細胞への侵入を促進する。内皮細胞がウイルスによって傷つけられると、サイトカインストームと呼ばれる炎症反応が起こり、血中の好中球やマクロファージ、脳内のミクログリアやアストロサイトが活性化される。内皮の損傷や、スパイク蛋白/ACE2相互作用によるSARS-CoV-2による血小板の直接活性化[17]は、微小血栓の形成を促進し、それが血栓に発展する可能性もある。このように、ケモカインである単球走化性タンパク質1とサイトカインによって引き起こされる血液脳関門(BBB)の不安定化により、SARS-CoV-2はBBBを自由に通過することができるようになるのである。
そして、脳内に侵入したウイルスは、増殖の機会を得ることになる。SARS-CoV-2は、ヒトの脳細胞オルガノイドを用いて実証されたように、ニューロン細胞の仕組みを利用して複製する能力を持っている[18]。さらに、COVID-19と診断された患者の脳生検では、SARS-CoV-2がニューロンそのものを標的にして複製することができることが示された[18]。しかし、サイトカインの嵐をもたらす神経炎症が、ミクログリアの活性化をもたらす主要な要因であることが明らかになった。これにより、キヌレニン、キノリン酸、グルタミン酸が増加し、それに伴って神経伝達物質のセロトニン、ドーパミン、ノルエピネフリンが枯渇し、COVID-19やニューロンの損傷に伴う精神神経症状が引き起こされるのである[14]。
脳に影響を及ぼす他のウイルス感染に基づき、中枢神経系へのSARS-CoV-2感染は、一部の患者にとって長期的な神経学的結果につながる可能性が示唆されている[19]。SARS-CoV-2 causes brain inflammation and induces Lewy body formation in macaques" [20] と題するプレプリント(未査読)は、この懸念を強調するものである。この研究では、治療グループである4匹の雄のアカゲザルと4匹の雄のカニクイザルに、実験的にSARS-CoV-2を感染させた。対照群はアカゲザルの雄2匹とカニクイザルの雄2匹で構成された。サルは無症状で感染し、感染後5〜6週間で安楽死させ、その脳組織を免疫組織化学的にレビー小体について染色した。その結果、感染した8頭すべてのサルの尾状核の中脳領域で細胞内レビー小体の形成が認められたが、対照群のすべてのサルの脳にはレビー小体が認められなかった。これらの結果は、SARS-CoV-2がα-シヌクレインのミスフォールディングを引き起こす能力を持ち、それゆえSARS-CoV-2感染サルにおけるレビー小体形成に関与しているという有力な証拠である。
もし、SARS-CoV-2感染から回復した患者の脳で、同じようにα-シヌクレインのミスフォールディング(=α-シヌクレインプリオン)、その凝集、レビー小体の形成が起こると、数十年後、あるいは数年後にパーキンソン病やレビー小体型認知症のような神経変性疾患に至る可能性がある。したがって、感染後に神経学的合併症を示すCOVID-19と診断された患者のフォローアップを行うことが不可欠である[21]。
もし、SARS-CoV-2感染から回復した患者の脳で、同じようにα-シヌクレインのミスフォールディング(=α-シヌクレインプリオン)、その凝集、レビー小体の形成が起こると、数十年後、あるいは数年後にパーキンソン病やレビー小体型認知症のような神経変性疾患に至る可能性がある。したがって、感染後に神経学的合併症を示すCOVID-19と診断された患者のフォローアップを行うことが不可欠である[21]。
現在、COVID-19の重症化を抑えるために認可されているワクチンは、mRNAまたはDNAをヒトの細胞に導入してSARS-CoV-2のスパイクタンパク質を生成し、これを抗原として身体の免疫系が標的となるようにしたものである。
スパイクタンパク質がBBBを通過する可能性があることは、SARS-CoV-2の精製スパイクタンパク質が脳の内皮細胞で炎症反応を引き起こし、それによってBBBを不安定にすることを示唆したin vitro研究[22]からも明らかである。次に、マウスを用いたin vivo研究では、ヨウ素化したS1サブユニットを雄マウスに静脈内投与したところ、スパイクタンパク質のS1サブユニットが容易にBBBを通過し、脳実質に入ることが実証された[23]。これらの現象をワクチン投与部位である三角筋に結びつけたのは、13人の医療従事者のうち11人で接種後約2週間までスパイクタンパク質のS1サブユニットが全身循環で検出可能であったという観察結果であった[24]。S1サブユニットの濃度は低かったが、この研究は、スパイクタンパク質またはその成分が接種後に循環に入る可能性があることを原理的に証明するものである。COVID-19ワクチンによる重篤な有害事象の発生率が比較的低いことを考慮すると、循環スパイクタンパク質が何らかの副作用の原因であったとしても、この研究のサンプルサイズは、循環スパイクタンパク質の濃度が比較的高い潜在的にまれな個人を特定するには小さすぎた。さらに、スパイクタンパク質が内皮細胞上のACE2レセプターにすでに結合していた可能性もある。
スパイクタンパク質のS1サブユニットだけが、Toll様受容体4を介したシグナル伝達を介して炎症反応を開始する責任があることが証明された[25]。また、スパイク蛋白質単独では、血小板表面のACE2と結合すると、血小板機能を調節し、その結果、血栓形成が起こることが示された[17]。このように、スパイク蛋白質は、SARS-CoV-2感染後に観察される病態の主要な側面を再現することができることが明らかである。
スパイクタンパク質がBBBを通過する可能性があることは、SARS-CoV-2の精製スパイクタンパク質が脳の内皮細胞で炎症反応を引き起こし、それによってBBBを不安定にすることを示唆したin vitro研究[22]からも明らかである。次に、マウスを用いたin vivo研究では、ヨウ素化したS1サブユニットを雄マウスに静脈内投与したところ、スパイクタンパク質のS1サブユニットが容易にBBBを通過し、脳実質に入ることが実証された[23]。これらの現象をワクチン投与部位である三角筋に結びつけたのは、13人の医療従事者のうち11人で接種後約2週間までスパイクタンパク質のS1サブユニットが全身循環で検出可能であったという観察結果であった[24]。S1サブユニットの濃度は低かったが、この研究は、スパイクタンパク質またはその成分が接種後に循環に入る可能性があることを原理的に証明するものである。COVID-19ワクチンによる重篤な有害事象の発生率が比較的低いことを考慮すると、循環スパイクタンパク質が何らかの副作用の原因であったとしても、この研究のサンプルサイズは、循環スパイクタンパク質の濃度が比較的高い潜在的にまれな個人を特定するには小さすぎた。さらに、スパイクタンパク質が内皮細胞上のACE2レセプターにすでに結合していた可能性もある。
スパイクタンパク質のS1サブユニットだけが、Toll様受容体4を介したシグナル伝達を介して炎症反応を開始する責任があることが証明された[25]。また、スパイク蛋白質単独では、血小板表面のACE2と結合すると、血小板機能を調節し、その結果、血栓形成が起こることが示された[17]。このように、スパイク蛋白質は、SARS-CoV-2感染後に観察される病態の主要な側面を再現することができることが明らかである。
パンデミックの間、ワクチンメーカーは主に自社製品の有効性を評価することに重点を置いていた[26,27,28]。しかし、前述のように他のコロナウイルスでの経験から、スパイクタンパク質が観察された病態に大きく関与していることがすでに知られていた。したがって,COVID-19ワクチンを接種した人のうち,神経系の副作用(例えば,激しい頭痛)を起こした人の中から,接種後20〜30年まで,パーキンソン病やレビー小体型認知症と診断されるシヌクレインパチーの神経症状を示す可能性があるという理論的シナリオが存在することになる.米国食品医薬品局(FDA)の説明文書で、ファイザー社はCOVID-19ワクチンに関して次のように述べている。「本ワクチンの承認後、多数の人々に使用することにより、現時点までの、約44,000人の参加者からなる安全性試験集団の追跡調査中には検出されなかった追加の、頻度の低い、あるいはより深刻な有害事象が明らかになる可能性がある。新たな安全性シグナルを検出するため、承認期間中、能動的および受動的な安全性サーベイランスが継続される。」他のメーカーも同様の声明を出している。製薬業界は、この承認後期間中に能動的および受動的な安全性監視を開始することを自らに課しているのである。2021年8月23日、BioNTech Manufacturing GmbH(米国ニューヨーク州ニューヨークのファイザー社と提携)は、現在「COMIRNATY」として販売されているCOVID-19 mRNAワクチンBNT162b2について米国FDAの生物製剤承認申請認可(STN:BL 125742/0)を取得した[29]。
2020年初頭にCOVID-19のパンデミックが宣言され、呼吸器疾患と分類されたとき、議論が深刻な神経学的影響の問題へと進展すると思った者はほとんどいなかっただろう。私たちはすでに、神経学的合併症を経験した患者のα-シヌクレイン・プリオンを注意深く監視しスクリーニングする必要性を認識しているが、ワクチンを接種した人についてはどうであろうか。この1年間で、COVID-19ワクチンの神経学的副作用は極めてまれであることを示すいくつかの論文が発表されている。これは、実際に投与された回数を考慮すると、著者が述べているように、かなり重篤な有害事象に当てはまる[30,31,32,33]。しかし、だからといって、これらの人たちをフォローアップする必要があることを否定するものではない。また、BioNTech Manufacturing GmbH(ファイザー社との提携)により最近FDAで承認されたCOVID-19ワクチン「COMIRNATY」の添付文書[34]によると、深刻ではないと考えられるが、急性神経症状(すなわち、疲労および/または頭痛)の発生が、特に若い年齢層(16歳から55歳)で高いことが注目される。このような神経症状は、特に長引くと、免疫後20〜30年までパーキンソン病のようなシヌクレオパシーを生じさせる誘因として作用しうる炎症を示している可能性が十分にある[21]。したがって,COVID-19ワクチン投与後に神経学的な副作用を経験した個人は,追跡調査を受ける必要がある.
興味深いのは、現在使用されているCOVID-19ワクチンの作用機序である。最終生成物はSARS-CoV-2のスパイクタンパク質で、標的は免疫系の抗原提示細胞である。しかし、これらのワクチンによって生成されたスパイクタンパク質は、目的外の効果を持つ可能性があるという指摘がある[17,34,35,36]。スパイクタンパク質の分布やトキシコキネティックの研究が行われたという証拠はない [34,37]。このことを念頭に置き、神経学的合併症を起こしたCOVID-19による入院患者に加え、COVID-19ワクチンの結果として神経学的副作用を経験した被験者を追跡調査することが賢明であると思われる。COVID-19ワクチンでは、宿主細胞で産生されたスパイクタンパク質が全身循環に排出されないという仮定がなされている。したがって、すでに病気の原因となることが知られているスパイクタンパク質の毒性と分布を明らかにするために、さらなるデータが必要である。十分な安全マージンを提供するために、適切なラボで、適切な種を用いて、ワクチン接種後に血漿に入る濃度だけでなくそれ以上の濃度でも[24]、標準的な28日間試験が開始されるべきだろう。他の規制された研究も、知識のギャップを埋めるために必要とみなされるかもしれない。おそらく使用されるべきであった産業界向けのガイダンスは、「治験用細胞・遺伝子治療製品の前臨床評価」 [38] である。しかし、同じく勧告に拘束力がない「COVID-19を予防するためのワクチンの開発と認可に関する産業界向けガイダンス」 [39] と同様に、前者のガイダンスでは完全病理組織を含むより広範囲の非臨床試験を推奨し、序文において次のように述べている:「生物製剤評価研究センター(CBER)/細胞・組織・遺伝子治療室(OCTGT)は、前臨床試験を計画・実施するスポンサーと個人に対して、OCTGTが審査する治験用細胞治療、遺伝子治療、治療用ワクチン、異種移植、および特定の生物学的装置との組み合わせ製品(以下CGT製品)の臨床試験をサポートするために必要となる前臨床情報の内容や範囲について勧告するためにこのガイドラインを発行する 。」
これらの必要な研究が行われ、結果が立証されるまでは、COVID-19ワクチンを低年齢層に投与するかどうかを決定する際には、注意が必要であることを示唆している。
興味深いのは、現在使用されているCOVID-19ワクチンの作用機序である。最終生成物はSARS-CoV-2のスパイクタンパク質で、標的は免疫系の抗原提示細胞である。しかし、これらのワクチンによって生成されたスパイクタンパク質は、目的外の効果を持つ可能性があるという指摘がある[17,34,35,36]。スパイクタンパク質の分布やトキシコキネティックの研究が行われたという証拠はない [34,37]。このことを念頭に置き、神経学的合併症を起こしたCOVID-19による入院患者に加え、COVID-19ワクチンの結果として神経学的副作用を経験した被験者を追跡調査することが賢明であると思われる。COVID-19ワクチンでは、宿主細胞で産生されたスパイクタンパク質が全身循環に排出されないという仮定がなされている。したがって、すでに病気の原因となることが知られているスパイクタンパク質の毒性と分布を明らかにするために、さらなるデータが必要である。十分な安全マージンを提供するために、適切なラボで、適切な種を用いて、ワクチン接種後に血漿に入る濃度だけでなくそれ以上の濃度でも[24]、標準的な28日間試験が開始されるべきだろう。他の規制された研究も、知識のギャップを埋めるために必要とみなされるかもしれない。おそらく使用されるべきであった産業界向けのガイダンスは、「治験用細胞・遺伝子治療製品の前臨床評価」 [38] である。しかし、同じく勧告に拘束力がない「COVID-19を予防するためのワクチンの開発と認可に関する産業界向けガイダンス」 [39] と同様に、前者のガイダンスでは完全病理組織を含むより広範囲の非臨床試験を推奨し、序文において次のように述べている:「生物製剤評価研究センター(CBER)/細胞・組織・遺伝子治療室(OCTGT)は、前臨床試験を計画・実施するスポンサーと個人に対して、OCTGTが審査する治験用細胞治療、遺伝子治療、治療用ワクチン、異種移植、および特定の生物学的装置との組み合わせ製品(以下CGT製品)の臨床試験をサポートするために必要となる前臨床情報の内容や範囲について勧告するためにこのガイドラインを発行する 。」
これらの必要な研究が行われ、結果が立証されるまでは、COVID-19ワクチンを低年齢層に投与するかどうかを決定する際には、注意が必要であることを示唆している。
P.R.O.は、プリオン病に焦点を当てた研究に協力し、発表している。J.H.は、COVID-19の専門知識を深め、早期治療戦略を提唱している医療専門家である。B.W.B.はウイルス免疫学者で、その研究プログラムと発表歴は、新しいワクチン接種戦略の開発に重点を置いている。3名の共著者全員が、本原稿の構想、デザイン、執筆、レビュー、改訂に貢献した。本論文の作成に使用したすべての情報源は、参考文献の欄に引用した。すべての著者は、この原稿の公開版に目を通し、同意している。
B.W.B.は、SARS-CoV-2のスパイクタンパク質を標的とした新規ワクチンの前臨床研究を行うための資金援助を受けた(COVID-19 Rapid Research Fund, Ontario Ministry of Colleges and Universities; Pandemic Response Challenge Program Grant, National Research Council of Canada).資金提供者は、本原稿の構想、執筆、出版には一切関与していない。
Nath, A. Neurologic complications of coronavirus infections. Neurology 2020, 94, 809–810. [Google Scholar] [CrossRef]
Alquisiras-Burgos, I.; Peralta-Arrieta, I.; Alonso-Palomares, L.A.; Zacapala-Gómez, A.E.; Salmerón-Bárcenas, E.; Aguilera, P. Neurological Complications Associated with the Blood-Brain Barrier Damage Induced by the Inflammatory Response during SARS-CoV-2 Infection. Mol. Neurobiol. 2020, 58, 520–535. [Google Scholar] [CrossRef]
Petrosillo, N.; Viceconte, G.; Ergonul, O.; Ippolito, G.; Petersen, E. COVID-19, SARS and MERS: Are they closely related? Clin. Microbiol. Inf. 2020, 26, 729–734. [Google Scholar] [CrossRef] [PubMed]
Hui, D.S.C.; Zumla, A. Severe Acute Respiratory Syndrome, Historical, Epidemiologic, and Clinical Features. Infect. Dis Clin. N. Am. 2019, 33, 869–889. [Google Scholar] [CrossRef]
Saad, M.; Omrani, A.S.; Baig, K.; Bahloul, A.; Elzein, F.; Matin, M.A.; Selim, M.A.A.; Al-Mutairi, M.; Al-Nakhli, D.; Al-Aidaroos, A.Y.; et al. Clinical aspects and outcomes of 70 patients with Middle East respiratory syndrome coronavirus infection: A single-center experience in Saudi Arabia. Int. J. Infect. Dis. 2014, 29, 301–306. [Google Scholar] [CrossRef] [PubMed]
Government of Canada. COVID-19 Sgns, Symptoms and Severity of Disease: A Clinician Guide. Available online: https://www.canada.ca/en/public-health/services/di... (accessed on 17 June 2021).
Mian, M.S.; Khan, L.R.S.; Hussain, N.; Razaq, M. Pathological Findings and Management of COVID-19 Patients: A Brief Overview of Modern-day Pandemic. Cureus 2020, 12, e8136. [Google Scholar] [CrossRef] [PubMed]
Zhou, J.; Chu, H.; Li, C.; Wong, B.H.-Y.; Cheng, Z.-S.; Poon, V.W.-M.; Sun, T.; Lau, C.C.-Y.; Wong, K.K.-Y.; Chan, J.Y.-W.; et al. Active Replication of Middle East Respiratory Syndrome Coronavirus and Aberrant Induction of Inflammatory Cytokines and Chemokines in Human Macrophages: Implications for Pathogenesis. J. Infect. Dis. 2014, 209, 1331–1342. [Google Scholar] [CrossRef] [PubMed]
Liang, Y.; Wang, M.-L.; Chien, C.-S.; Yarmishyn, A.A.; Yang, Y.-P.; Lai, W.-Y.; Luo, Y.-H.; Lin, Y.-T.; Chen, Y.-J.; Chang, P.-C.; et al. Highlight of Immune Pathogenic Response and Hematopathologic Effect in SARS-CoV, MERS-CoV, and SARS-CoV-2 Infection. Front. Immu. 2020, 11, 1022. [Google Scholar] [CrossRef]
Kuba, K.; Imai, Y.; Rao, S.; Gao, H.; Guo, F.; Guan, B.; Huan, Y.; Yang, P.; Zhang, Y.; Deng, W.; et al. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus–induced lung injury. Nat. Med. 2005, 11, 875–879. [Google Scholar] [CrossRef]
Mahmood, S.S.; Pinsky, M.R. Heart-lung interactions during mechanical ventilation: The basics. Ann. Transl. Med. 2018, 6, 349. [Google Scholar] [CrossRef]
Ahmed, H.; Patel, K.; Greenwood, D.C.; Halpin, S.; Lewthwaite, P.; Salawu, A.; Eyre, L.; Breen, A.; O’Connor, R.; Jones, A.; et al. Long-term Clinical Outcomes in Survivors of Severe Acute Respiratory Syndrome (SARS) and Middle East Respiratory Syndrome (MERS) Coronavirus Outbreaks After Hospitalisation or ICU Admission: A Systematic Review and Meta-Analysis. J. Rehabil. Med. 2020, 52, 1–11. [Google Scholar] [CrossRef]
Ngai, J.C.; Ko, F.W.; Ng, S.S.; To, K.-W.; Tong, M.; Hui, D.S. The long-term impact of severe acute respiratory syndrome on pulmonary function, exercise capacity and health status. Respirology 2010, 15, 543–550. [Google Scholar] [CrossRef] [PubMed]
Boldrini, M.; Canoll, P.D.; Klein, R.S. How COVID-19 Affects the Brain. JAMA Psych. Clin. Rev. Educ. 2021, 78, 682–683. [Google Scholar] [CrossRef] [PubMed]
Brann, D.H.; Tsukahara, T.; Weinreb, C.; Lipovsek, M.; Van den Berge, K.; Gong, B.; Chance, R.; Macaulay, I.C.; Chou, H.-J.; Fletcher, R.; et al. Non-neuronal expression of SARS-CoV-2 entry genes in the olfactory system suggests mechanisms underlying COVID-19 associated anosmia. bioRxiv 2020. preprint. [Google Scholar] [CrossRef]
Fodoulian, L.; Tuberosa, J.; Rossier, D.; Boillat, M.; Kan, C.; Pauli, V.; Egervari, K.; Lobrinus, J.A.; Landis, B.N.; Carleton, A.; et al. SARS-CoV-2 receptor and entry genes are expressed by sustentacular cells in the human olfactory neuroepithelium. bioRxiv 2020. preprint. [Google Scholar] [CrossRef]
Zhang, S.; Liu, Y.; Wang, X.; Yang, L.; Li, H.; Wang, Y.; Liu, M.; Zhao, X.; Xie, Y.; Yang, Y.; et al. SARS-CoV-2 binds platelet ACE2 to enhance thrombosis in COVID-19. J. Hematol. Oncol. 2020, 13, 1–22. [Google Scholar] [CrossRef]
Song, E.; Zhang, C.; Israelow, B.; Lu-Culligan, A.; Prado, A.V.; Skriabine, S.; Lu, P.; Weizman, O.-E.; Liu, F.; Dai, Y.; et al. Neuroinvasion of SARS-CoV-2 in human and mouse brain. J. Exp. Med. 2021, 218, 1–18. [Google Scholar] [CrossRef]
Lippi, A.; Domingues, R.; Setz, C.; Outeiro, T.F.; Krisko, A. SARS-CoV-2: At the Crossroad between Aging and Neurodegeneration. Mov. Disord. 2020, 35, 716–720. [Google Scholar] [CrossRef]
Philippens, I.H.C.H.M.; Böszörményi, K.P.; Wubben, J.A.; Fagrouch, Z.C.; van Driel, N.; Mayenburg, A.Q.; Lozovagia, D.; Roos, E.; Schurink, B.; Bugiani, M.; et al. SARS-CoV-2 causes brain inflammation and induces Lewy body formation in macaques. bioRxiv 2021. preprint. [Google Scholar] [CrossRef]
Brundin, P.; Nath, A.; Beckham, D.J. Is COVID-19 a perfect storm for Parkinson’s disease. Trends Neurosci. 2020, 43, 931–933. [Google Scholar] [CrossRef]
Buzhdygan, T.P.; DeOre, B.J.; Bawdwin-Leclair, A.; Bullock, T.A.; McGary, H.M.; Khan, J.A.; Razmpour, R.; Hale, J.F.; Galie, P.A.; Potula, R.; et al. The SARS-CoV-2 spike protein alters barrier function in 2D static and 3D microfluidic in-vitro models of the human blood–brain barrier. Neurobiol. Dis. 2020, 146, 105131. [Google Scholar] [CrossRef]
Rhea, E.M.; Logsdon, A.F.; Hansen, K.M.; Williams, L.M.; Reed, M.J.; Baumann, K.K.; Holden, S.J.; Raber, J.; Banks, W.A.; Erickson, M.A. The S1 protein of SARS-CoV-2 crosses the blood–brain barrier in mice. Nat. Neurosci. 2021, 24, 368–378. [Google Scholar] [CrossRef]
Ogata, A.F.; Cheng, C.; Desjardins, M.; Senussi, Y.; Sherman, A.C.; Powell, M.; Novack, L.; Von, S.; Li, X.; Baden, L.R.; et al. Circulating SARS-CoV-2 Vaccine Antigen Detected in the Plasma of mRNA-1273 Vaccine Recipients. Clin. Infect. Dis. 2021, ciab465. [Google Scholar] [CrossRef] [PubMed]
Shirato, K.; Kizaki, T. SARS-CoV-2 spike protein S1 subunit induces pro-inflammatory responses via toll-like receptor 4 signaling in murine and human macrophages. Heliyon 2021, 7, 2–10. [Google Scholar] [CrossRef]
FDA. FDA Briefing Document Pfizer-BioNTech COVID-19 Vaccine. Available online: https://www.fda.gov/media/144245/download (accessed on 27 April 2021).
European Medicines Agency. Assessment Report-COVID-19 Vaccine Moderna (EMA/15689/2021). Available online: https://www.ema.europa.eu/en/documents/assessment-... (accessed on 6 January 2021).
European Medicines Agency. Assessment Report-COVID-19 Vaccine Janssen (EMA/158424/2021). Available online: https://www.ema.europa.eu/en/documents/assessment-... (accessed on 11 March 2021).
FDA. BLA (STN: BL 125742/0) Approval Letter. Available online: https://www.fda.gov/media/151710/download (accessed on 23 August 2021).
Lu, L.; Xiong, W.; Mu, J.; Zhang, Q.; Zhang, H.; Zou, L.; Li, W.; He, L.; Sander, J.W.; Zhou, D. The potential neurological effect of the COVID-19 vaccines: A review. Acta Neurol. Scand. 2021, 144, 3–12. [Google Scholar] [CrossRef]
Goss, A.L.; Samudralwar, R.D.; Das, R.R.; Nath, A. ANA Investigates: Neurological Complications of COVID-19 Vaccines. Ann. Neurol. 2021, 89, 856–857. [Google Scholar] [CrossRef]
Jing-Han, N.; Chaudhuri, K.R.; Tan, E.-K. Functional Neurological Disorders and COVID-19 Vaccination. Ann. Neurol. 2020, 90, 328. [Google Scholar]
Lu, L.; Xiong, W.; Mu, J.; Zhang, Q.; Zhang, H.; Zou, L.; Li, W.; He, L.; Sander, J.W.; Zhou, D. Neurological side effects of COVID-19 vaccines are rare. Acta Neurol. Scand. 2021, 144, 111–112. [Google Scholar] [CrossRef] [PubMed]
The Label. COMIRNATY® (COVID-19 Vaccine, mRNA) Suspension for Injection, for Intramuscular Use. Initial U.S. Approval: 2021. Available online: https://www.fda.gov/media/151707/download (accessed on 25 August 2021).
Bansal, S.; Perincheri, S.; Fleming, T.; Poulson, C.; Tiffany, B.; Bremner, R.M.; Mohanakumar, T. Cutting Edge: Circulating Exosomes with COVID Spike Protein Are Induced by BNT162b2 (Pfizer-BioNTech) Vaccination prior to Development of Antibodies: A Novel Mechanism for Immune Activation by mRNA Vaccines. J. Immunol. 2021, 207, 1–6. Available online: www.jimmunol.org/cgi/doi/10.4049/jimmunol.2100637 (accessed on 15 October 2021). [CrossRef] [PubMed]
Centers for Disease Control and Prevention (CDC). Clinical Considerations: Myocarditis and Pericarditis after Receipt of mRNA COVID-19 Vaccines among Adolescents and Young Adults. Available online: https://www.cdc.gov/vaccines/covid-19/clinical-con... (accessed on 10 December 2021).
FDA-Summary Basis for Regulatory Action Date: 23 August 2021. Submitted a Biologics License Application (BLA) STN BL 125742 for Licensure of COVID-19 Vaccine, mRNA. Available online: https://www.fda.gov/media/151733/download (accessed on 23 August 2021).
FDA-Guidance for Industry Preclinical Assessment of Investigational Cellular and Gene Therapy Products—(Issued November 2013). Available online: https://www.fda.gov/media/87564/download (accessed on 7 November 2021).
FDA-Development and Licensure of Vaccines to Prevent COVID-19 Guidance for Industry—(Issued June 2020). Available online: https://www.fda.gov/media/139638/download (accessed on 7 November 2021).
Alquisiras-Burgos, I.; Peralta-Arrieta, I.; Alonso-Palomares, L.A.; Zacapala-Gómez, A.E.; Salmerón-Bárcenas, E.; Aguilera, P. Neurological Complications Associated with the Blood-Brain Barrier Damage Induced by the Inflammatory Response during SARS-CoV-2 Infection. Mol. Neurobiol. 2020, 58, 520–535. [Google Scholar] [CrossRef]
Petrosillo, N.; Viceconte, G.; Ergonul, O.; Ippolito, G.; Petersen, E. COVID-19, SARS and MERS: Are they closely related? Clin. Microbiol. Inf. 2020, 26, 729–734. [Google Scholar] [CrossRef] [PubMed]
Hui, D.S.C.; Zumla, A. Severe Acute Respiratory Syndrome, Historical, Epidemiologic, and Clinical Features. Infect. Dis Clin. N. Am. 2019, 33, 869–889. [Google Scholar] [CrossRef]
Saad, M.; Omrani, A.S.; Baig, K.; Bahloul, A.; Elzein, F.; Matin, M.A.; Selim, M.A.A.; Al-Mutairi, M.; Al-Nakhli, D.; Al-Aidaroos, A.Y.; et al. Clinical aspects and outcomes of 70 patients with Middle East respiratory syndrome coronavirus infection: A single-center experience in Saudi Arabia. Int. J. Infect. Dis. 2014, 29, 301–306. [Google Scholar] [CrossRef] [PubMed]
Government of Canada. COVID-19 Sgns, Symptoms and Severity of Disease: A Clinician Guide. Available online: https://www.canada.ca/en/public-health/services/di... (accessed on 17 June 2021).
Mian, M.S.; Khan, L.R.S.; Hussain, N.; Razaq, M. Pathological Findings and Management of COVID-19 Patients: A Brief Overview of Modern-day Pandemic. Cureus 2020, 12, e8136. [Google Scholar] [CrossRef] [PubMed]
Zhou, J.; Chu, H.; Li, C.; Wong, B.H.-Y.; Cheng, Z.-S.; Poon, V.W.-M.; Sun, T.; Lau, C.C.-Y.; Wong, K.K.-Y.; Chan, J.Y.-W.; et al. Active Replication of Middle East Respiratory Syndrome Coronavirus and Aberrant Induction of Inflammatory Cytokines and Chemokines in Human Macrophages: Implications for Pathogenesis. J. Infect. Dis. 2014, 209, 1331–1342. [Google Scholar] [CrossRef] [PubMed]
Liang, Y.; Wang, M.-L.; Chien, C.-S.; Yarmishyn, A.A.; Yang, Y.-P.; Lai, W.-Y.; Luo, Y.-H.; Lin, Y.-T.; Chen, Y.-J.; Chang, P.-C.; et al. Highlight of Immune Pathogenic Response and Hematopathologic Effect in SARS-CoV, MERS-CoV, and SARS-CoV-2 Infection. Front. Immu. 2020, 11, 1022. [Google Scholar] [CrossRef]
Kuba, K.; Imai, Y.; Rao, S.; Gao, H.; Guo, F.; Guan, B.; Huan, Y.; Yang, P.; Zhang, Y.; Deng, W.; et al. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus–induced lung injury. Nat. Med. 2005, 11, 875–879. [Google Scholar] [CrossRef]
Mahmood, S.S.; Pinsky, M.R. Heart-lung interactions during mechanical ventilation: The basics. Ann. Transl. Med. 2018, 6, 349. [Google Scholar] [CrossRef]
Ahmed, H.; Patel, K.; Greenwood, D.C.; Halpin, S.; Lewthwaite, P.; Salawu, A.; Eyre, L.; Breen, A.; O’Connor, R.; Jones, A.; et al. Long-term Clinical Outcomes in Survivors of Severe Acute Respiratory Syndrome (SARS) and Middle East Respiratory Syndrome (MERS) Coronavirus Outbreaks After Hospitalisation or ICU Admission: A Systematic Review and Meta-Analysis. J. Rehabil. Med. 2020, 52, 1–11. [Google Scholar] [CrossRef]
Ngai, J.C.; Ko, F.W.; Ng, S.S.; To, K.-W.; Tong, M.; Hui, D.S. The long-term impact of severe acute respiratory syndrome on pulmonary function, exercise capacity and health status. Respirology 2010, 15, 543–550. [Google Scholar] [CrossRef] [PubMed]
Boldrini, M.; Canoll, P.D.; Klein, R.S. How COVID-19 Affects the Brain. JAMA Psych. Clin. Rev. Educ. 2021, 78, 682–683. [Google Scholar] [CrossRef] [PubMed]
Brann, D.H.; Tsukahara, T.; Weinreb, C.; Lipovsek, M.; Van den Berge, K.; Gong, B.; Chance, R.; Macaulay, I.C.; Chou, H.-J.; Fletcher, R.; et al. Non-neuronal expression of SARS-CoV-2 entry genes in the olfactory system suggests mechanisms underlying COVID-19 associated anosmia. bioRxiv 2020. preprint. [Google Scholar] [CrossRef]
Fodoulian, L.; Tuberosa, J.; Rossier, D.; Boillat, M.; Kan, C.; Pauli, V.; Egervari, K.; Lobrinus, J.A.; Landis, B.N.; Carleton, A.; et al. SARS-CoV-2 receptor and entry genes are expressed by sustentacular cells in the human olfactory neuroepithelium. bioRxiv 2020. preprint. [Google Scholar] [CrossRef]
Zhang, S.; Liu, Y.; Wang, X.; Yang, L.; Li, H.; Wang, Y.; Liu, M.; Zhao, X.; Xie, Y.; Yang, Y.; et al. SARS-CoV-2 binds platelet ACE2 to enhance thrombosis in COVID-19. J. Hematol. Oncol. 2020, 13, 1–22. [Google Scholar] [CrossRef]
Song, E.; Zhang, C.; Israelow, B.; Lu-Culligan, A.; Prado, A.V.; Skriabine, S.; Lu, P.; Weizman, O.-E.; Liu, F.; Dai, Y.; et al. Neuroinvasion of SARS-CoV-2 in human and mouse brain. J. Exp. Med. 2021, 218, 1–18. [Google Scholar] [CrossRef]
Lippi, A.; Domingues, R.; Setz, C.; Outeiro, T.F.; Krisko, A. SARS-CoV-2: At the Crossroad between Aging and Neurodegeneration. Mov. Disord. 2020, 35, 716–720. [Google Scholar] [CrossRef]
Philippens, I.H.C.H.M.; Böszörményi, K.P.; Wubben, J.A.; Fagrouch, Z.C.; van Driel, N.; Mayenburg, A.Q.; Lozovagia, D.; Roos, E.; Schurink, B.; Bugiani, M.; et al. SARS-CoV-2 causes brain inflammation and induces Lewy body formation in macaques. bioRxiv 2021. preprint. [Google Scholar] [CrossRef]
Brundin, P.; Nath, A.; Beckham, D.J. Is COVID-19 a perfect storm for Parkinson’s disease. Trends Neurosci. 2020, 43, 931–933. [Google Scholar] [CrossRef]
Buzhdygan, T.P.; DeOre, B.J.; Bawdwin-Leclair, A.; Bullock, T.A.; McGary, H.M.; Khan, J.A.; Razmpour, R.; Hale, J.F.; Galie, P.A.; Potula, R.; et al. The SARS-CoV-2 spike protein alters barrier function in 2D static and 3D microfluidic in-vitro models of the human blood–brain barrier. Neurobiol. Dis. 2020, 146, 105131. [Google Scholar] [CrossRef]
Rhea, E.M.; Logsdon, A.F.; Hansen, K.M.; Williams, L.M.; Reed, M.J.; Baumann, K.K.; Holden, S.J.; Raber, J.; Banks, W.A.; Erickson, M.A. The S1 protein of SARS-CoV-2 crosses the blood–brain barrier in mice. Nat. Neurosci. 2021, 24, 368–378. [Google Scholar] [CrossRef]
Ogata, A.F.; Cheng, C.; Desjardins, M.; Senussi, Y.; Sherman, A.C.; Powell, M.; Novack, L.; Von, S.; Li, X.; Baden, L.R.; et al. Circulating SARS-CoV-2 Vaccine Antigen Detected in the Plasma of mRNA-1273 Vaccine Recipients. Clin. Infect. Dis. 2021, ciab465. [Google Scholar] [CrossRef] [PubMed]
Shirato, K.; Kizaki, T. SARS-CoV-2 spike protein S1 subunit induces pro-inflammatory responses via toll-like receptor 4 signaling in murine and human macrophages. Heliyon 2021, 7, 2–10. [Google Scholar] [CrossRef]
FDA. FDA Briefing Document Pfizer-BioNTech COVID-19 Vaccine. Available online: https://www.fda.gov/media/144245/download (accessed on 27 April 2021).
European Medicines Agency. Assessment Report-COVID-19 Vaccine Moderna (EMA/15689/2021). Available online: https://www.ema.europa.eu/en/documents/assessment-... (accessed on 6 January 2021).
European Medicines Agency. Assessment Report-COVID-19 Vaccine Janssen (EMA/158424/2021). Available online: https://www.ema.europa.eu/en/documents/assessment-... (accessed on 11 March 2021).
FDA. BLA (STN: BL 125742/0) Approval Letter. Available online: https://www.fda.gov/media/151710/download (accessed on 23 August 2021).
Lu, L.; Xiong, W.; Mu, J.; Zhang, Q.; Zhang, H.; Zou, L.; Li, W.; He, L.; Sander, J.W.; Zhou, D. The potential neurological effect of the COVID-19 vaccines: A review. Acta Neurol. Scand. 2021, 144, 3–12. [Google Scholar] [CrossRef]
Goss, A.L.; Samudralwar, R.D.; Das, R.R.; Nath, A. ANA Investigates: Neurological Complications of COVID-19 Vaccines. Ann. Neurol. 2021, 89, 856–857. [Google Scholar] [CrossRef]
Jing-Han, N.; Chaudhuri, K.R.; Tan, E.-K. Functional Neurological Disorders and COVID-19 Vaccination. Ann. Neurol. 2020, 90, 328. [Google Scholar]
Lu, L.; Xiong, W.; Mu, J.; Zhang, Q.; Zhang, H.; Zou, L.; Li, W.; He, L.; Sander, J.W.; Zhou, D. Neurological side effects of COVID-19 vaccines are rare. Acta Neurol. Scand. 2021, 144, 111–112. [Google Scholar] [CrossRef] [PubMed]
The Label. COMIRNATY® (COVID-19 Vaccine, mRNA) Suspension for Injection, for Intramuscular Use. Initial U.S. Approval: 2021. Available online: https://www.fda.gov/media/151707/download (accessed on 25 August 2021).
Bansal, S.; Perincheri, S.; Fleming, T.; Poulson, C.; Tiffany, B.; Bremner, R.M.; Mohanakumar, T. Cutting Edge: Circulating Exosomes with COVID Spike Protein Are Induced by BNT162b2 (Pfizer-BioNTech) Vaccination prior to Development of Antibodies: A Novel Mechanism for Immune Activation by mRNA Vaccines. J. Immunol. 2021, 207, 1–6. Available online: www.jimmunol.org/cgi/doi/10.4049/jimmunol.2100637 (accessed on 15 October 2021). [CrossRef] [PubMed]
Centers for Disease Control and Prevention (CDC). Clinical Considerations: Myocarditis and Pericarditis after Receipt of mRNA COVID-19 Vaccines among Adolescents and Young Adults. Available online: https://www.cdc.gov/vaccines/covid-19/clinical-con... (accessed on 10 December 2021).
FDA-Summary Basis for Regulatory Action Date: 23 August 2021. Submitted a Biologics License Application (BLA) STN BL 125742 for Licensure of COVID-19 Vaccine, mRNA. Available online: https://www.fda.gov/media/151733/download (accessed on 23 August 2021).
FDA-Guidance for Industry Preclinical Assessment of Investigational Cellular and Gene Therapy Products—(Issued November 2013). Available online: https://www.fda.gov/media/87564/download (accessed on 7 November 2021).
FDA-Development and Licensure of Vaccines to Prevent COVID-19 Guidance for Industry—(Issued June 2020). Available online: https://www.fda.gov/media/139638/download (accessed on 7 November 2021).


コメントをかく