ヘモグロビンとは、赤血球の中にあるタンパク質である。酸素分子と結合する性質を持ち、肺から全身へと酸素を運搬する役割を担っている。赤色素であるヘム?をもっているため赤色を帯びている。人のヘモグロビンにはαサブユニットとβサブユニットと呼ばれる2種類のサブユニットがあり、α2つとβ2つが合わさってできた四量体構造をしている。
:下図の注意:右のやつが赤血球の中に大量に入っている!ヘモグロビンはかなり小さいよ!図が誤解を招きかねない。。。。
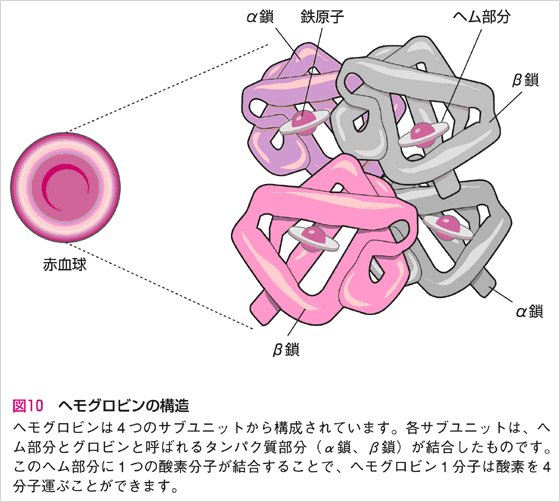
ヘモグロビン全体(α2β2)の分子量は約64,500であり、ヘムを4つ含む。ヘムは価数が2価の鉄原子を中央に配位したポルフィリン誘導体?である。このヘムの鉄原子に酸素が結合し、血液中を通って各組織へ運搬する。血中酸素分圧の高いところ(酸素の濃いとこ、たとえば肺)で酸素と結合し、低いところ(たとえば末梢組織)で酸素を放出する。1つのヘムに酸素が結合するとその情報がその他のヘムに伝達され、タンパク質の四次立体構造が変化し、他のヘムの酸素結合性が増えより酸素と結合しやすくなる。このことをヘム間相互作用?といい、酸素運搬効率を高めている。また、pHが低く二酸化炭素が多い環境下では、、酸素との親和性が下がる(ボーア効果?)。
嫌気的解糖?(酸素が少ない環境下での、酸素を用いないブドウ糖の分解によるエネルギー産生)の中間代謝産物であるグリセリン2,3-リン酸(2,3-diphosphoglycerate:2,3-DPG)がβサブユニットに結合することによっても酸素との親和性が下がる。
ヘム間相互作用と、それに拮抗して働く水素イオン、二酸化炭素、2,3-DPG効果のためにヘモグロビンの酸素解離度曲線?はシグモイド状になり、酸素分圧が高い肺胞毛細血管では酸素と結合しやすく、酸素分圧が低く、二酸化炭素濃度が多い末梢組織では酸素と解離しやすくなっており、効率よく酸素運搬が行われる。

酸素と結合したヘモグロビンは酸素化ヘモグロビン、酸素と結合していないヘモグロビンは還元ヘモグロビンと呼ばれる。
酸素化ヘモグロビンは鮮赤色で動脈血の色、デオキシヘモグロビンは暗赤色で静脈血の色である。デオキシヘモグロビンの鉄原子はポルフィリンの窒素原子とヒスチジン残基のイミダゾール?環の窒素原子と配位した四面体型であり、オキシヘモグロビンはイミダゾール環の反対側に酸素分子が結合して八面体型となっている。なお、ヘム部分に酸素が結合しても鉄は2価のままであり、酸化されにくい。しかし、一部は酸素の酸化力により、徐々に酸化されメトヘモグロビンになる(自動酸化)。赤血球中ではこの自動酸化を防ぐため還元酵素系が含まれる。このメトヘモグロビンをヘモグロビンに還元する酵素は、シトクロムb5レダクターゼ?である。
鉄原子の価数が3価であるメトヘモグロビンは、酸素と結合できず、かわりに水がヘムの鉄原子に結合している。こちらを『酸化』ヘモグロビンと呼ぶのが正しいのだが、オキシヘモグロビン(『酸素化』ヘモグロビン)との混同が極めて多いので、注意が必要である。
なお、血液中にメトヘモグロビンが多い状態をメトヘモグロビン血症?と言う。
異常ヘモグロビン
ヘモグロビンS: 鎌状赤血球症の原因となる。
ヘモグロビンH: サラセミアという貧血の原因となる。
ヘモグロビンSは正常なヘモグロビンに比べて非常に溶解度が小さく、このため分子が凝集しあって鎌形となっている。鎌状赤血球は遺伝子の異常によって起こっており、β鎖の6位のグルタミン酸がバリンに置き変わっていることが主な原因である。
一酸化炭素は酸素よりもはるかに強い親和性でヘモグロビンと結合するため、酸素運搬を阻害して毒性を発揮する一酸化炭素中毒。一酸化炭素の結合したヘモグロビンは光を照射することで、結合を切ることができる。?????どういう原理????
同じ呼吸色素であるミオグロビンはより酸素を放出しにくいので、筋肉のような酸素を多量に必要とする組織では、酸素の貯蔵庫として働くミオグロビンに酸素が渡される。
:下図の注意:右のやつが赤血球の中に大量に入っている!ヘモグロビンはかなり小さいよ!図が誤解を招きかねない。。。。

ヘモグロビン全体(α2β2)の分子量は約64,500であり、ヘムを4つ含む。ヘムは価数が2価の鉄原子を中央に配位したポルフィリン誘導体?である。このヘムの鉄原子に酸素が結合し、血液中を通って各組織へ運搬する。血中酸素分圧の高いところ(酸素の濃いとこ、たとえば肺)で酸素と結合し、低いところ(たとえば末梢組織)で酸素を放出する。1つのヘムに酸素が結合するとその情報がその他のヘムに伝達され、タンパク質の四次立体構造が変化し、他のヘムの酸素結合性が増えより酸素と結合しやすくなる。このことをヘム間相互作用?といい、酸素運搬効率を高めている。また、pHが低く二酸化炭素が多い環境下では、、酸素との親和性が下がる(ボーア効果?)。
嫌気的解糖?(酸素が少ない環境下での、酸素を用いないブドウ糖の分解によるエネルギー産生)の中間代謝産物であるグリセリン2,3-リン酸(2,3-diphosphoglycerate:2,3-DPG)がβサブユニットに結合することによっても酸素との親和性が下がる。
ヘム間相互作用と、それに拮抗して働く水素イオン、二酸化炭素、2,3-DPG効果のためにヘモグロビンの酸素解離度曲線?はシグモイド状になり、酸素分圧が高い肺胞毛細血管では酸素と結合しやすく、酸素分圧が低く、二酸化炭素濃度が多い末梢組織では酸素と解離しやすくなっており、効率よく酸素運搬が行われる。

酸素と結合したヘモグロビンは酸素化ヘモグロビン、酸素と結合していないヘモグロビンは還元ヘモグロビンと呼ばれる。
酸素化ヘモグロビンは鮮赤色で動脈血の色、デオキシヘモグロビンは暗赤色で静脈血の色である。デオキシヘモグロビンの鉄原子はポルフィリンの窒素原子とヒスチジン残基のイミダゾール?環の窒素原子と配位した四面体型であり、オキシヘモグロビンはイミダゾール環の反対側に酸素分子が結合して八面体型となっている。なお、ヘム部分に酸素が結合しても鉄は2価のままであり、酸化されにくい。しかし、一部は酸素の酸化力により、徐々に酸化されメトヘモグロビンになる(自動酸化)。赤血球中ではこの自動酸化を防ぐため還元酵素系が含まれる。このメトヘモグロビンをヘモグロビンに還元する酵素は、シトクロムb5レダクターゼ?である。
鉄原子の価数が3価であるメトヘモグロビンは、酸素と結合できず、かわりに水がヘムの鉄原子に結合している。こちらを『酸化』ヘモグロビンと呼ぶのが正しいのだが、オキシヘモグロビン(『酸素化』ヘモグロビン)との混同が極めて多いので、注意が必要である。
なお、血液中にメトヘモグロビンが多い状態をメトヘモグロビン血症?と言う。
異常ヘモグロビン
ヘモグロビンS: 鎌状赤血球症の原因となる。
ヘモグロビンH: サラセミアという貧血の原因となる。
ヘモグロビンSは正常なヘモグロビンに比べて非常に溶解度が小さく、このため分子が凝集しあって鎌形となっている。鎌状赤血球は遺伝子の異常によって起こっており、β鎖の6位のグルタミン酸がバリンに置き変わっていることが主な原因である。
一酸化炭素は酸素よりもはるかに強い親和性でヘモグロビンと結合するため、酸素運搬を阻害して毒性を発揮する一酸化炭素中毒。一酸化炭素の結合したヘモグロビンは光を照射することで、結合を切ることができる。?????どういう原理????
同じ呼吸色素であるミオグロビンはより酸素を放出しにくいので、筋肉のような酸素を多量に必要とする組織では、酸素の貯蔵庫として働くミオグロビンに酸素が渡される。
このページへのコメント
XoLfPt Looking forward to reading more. Great blog.Thanks Again. Keep writing.